题目内容
2.4克镁与稀盐酸恰好完全反应,计算:(1)在标准状态下生成H2多少升?
(2)若完全反应后所得溶液的体积为125毫升,则所得溶液的物质的量浓度为多少?
(3)若把镁离子全部转化为氢氧化镁则需要1mol/L的氢氧化钠多少毫升?
【答案】分析:(1)首先计算2.4g镁的物质的量,根据反应的化学方程式计算标准状态下生成H2的体积;
(2)根据c= 计算所得溶液的物质的量浓度;
计算所得溶液的物质的量浓度;
(3)根据反应Mg2++2OH-=Mg(OH)2↓计算需要1mol/L的氢氧化钠的体积.
解答:解:(1)n(Mg)=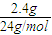 =0.1mol,
=0.1mol,
Mg+2HCl=MgCl2+H2↑
1mol 1mol 22.4L
0.1mol n(MgCl2) V(H2)
V(H2)=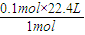 =2.24L,
=2.24L,
答:标准状态下生成H2的体积为2.24L;
(2)n(MgCl2)=0.1mol,
c(MgCl2)=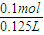 =0.8mol/L,
=0.8mol/L,
答:所得溶液的物质的量浓度为0.8mol/L;
(3)n(Mg2+)=n(MgCl2)=0.1mol,
Mg2++2OH-=Mg(OH)2↓
1 2
0.1mol n
n=0.2mol,即n(NaOH)=0.2mol,
所以:V=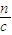 =
= =0.2L=200ml,
=0.2L=200ml,
答:需要1mol/L的氢氧化钠的体积为200ml.
点评:本题考查化学方程式的计算,题目难度不大,注意方程式的书写以及相关物理量计算公式的运用.
(2)根据c=
 计算所得溶液的物质的量浓度;
计算所得溶液的物质的量浓度;(3)根据反应Mg2++2OH-=Mg(OH)2↓计算需要1mol/L的氢氧化钠的体积.
解答:解:(1)n(Mg)=
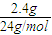 =0.1mol,
=0.1mol,Mg+2HCl=MgCl2+H2↑
1mol 1mol 22.4L
0.1mol n(MgCl2) V(H2)
V(H2)=
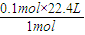 =2.24L,
=2.24L,答:标准状态下生成H2的体积为2.24L;
(2)n(MgCl2)=0.1mol,
c(MgCl2)=
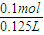 =0.8mol/L,
=0.8mol/L,答:所得溶液的物质的量浓度为0.8mol/L;
(3)n(Mg2+)=n(MgCl2)=0.1mol,
Mg2++2OH-=Mg(OH)2↓
1 2
0.1mol n
n=0.2mol,即n(NaOH)=0.2mol,
所以:V=
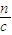 =
= =0.2L=200ml,
=0.2L=200ml,答:需要1mol/L的氢氧化钠的体积为200ml.
点评:本题考查化学方程式的计算,题目难度不大,注意方程式的书写以及相关物理量计算公式的运用.

练习册系列答案
相关题目