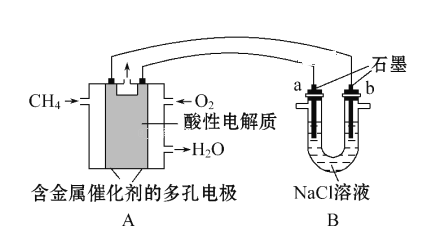
题目内容
【题目】对于密闭容器中反应:N2(g)+3H2(g)![]() 2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化关系如图。下列叙述正确的是( )
2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化关系如图。下列叙述正确的是( )
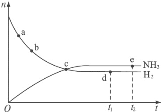
A. 用同种物质表示的正反应速率:点a比点b的小
B. 点c处反应达到平衡
C. 点d (t1时刻)和点e(t2时刻)处n(N2)不一样
D. 在给定条件下,t1时刻NH3的含量达到最高
【答案】D
【解析】
根据图像可知,a、b、c三点时,v(正)>v(逆);d、e为平衡状态;
A. a、b两点,氢气的浓度减小,用同种物质表示的正反应速率:点a比点b的大,A错误;
B. 点c处v(正)>v(逆),反应未达到平衡,B错误;
C. 点d (t1时刻)和点e(t2时刻)处v(正)=v(逆),n(N2)一样,C错误;
D. 在给定条件下,t1时刻反应达到平衡状态,则NH3的含量达到最高,D正确;
答案为D

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目