题目内容
在100℃时,NaCl溶液中c(H+)=1×10-6mol?L-1.下列说法中正确的是( )
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显中性 |
| C、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-12 |
考点:离子积常数
专题:电离平衡与溶液的pH专题
分析:氯化钠是强酸强碱盐,其溶液呈中性,则氯化钠溶液中存在c(H+)?c(OH-)=1×10-6mol?L-1,再结合Kw=c(H+)?c(OH-)解答.
解答:
解:A.氯化钠是强酸强碱盐,钠离子和氯离子都不水解,所以其溶液呈中性,故A错误;
B.根据A知,该溶液呈中性,故B正确;
C.该溶液呈中性,则c(H+)?c(OH-)=1×10-6mol?L-1,Kw=c(H+)?c(OH-)=1×10-12,故C错误;
D.根据C知,Kw=c(H+)?c(OH-)=1×10-12,故D正确;
故选BD.
B.根据A知,该溶液呈中性,故B正确;
C.该溶液呈中性,则c(H+)?c(OH-)=1×10-6mol?L-1,Kw=c(H+)?c(OH-)=1×10-12,故C错误;
D.根据C知,Kw=c(H+)?c(OH-)=1×10-12,故D正确;
故选BD.
点评:本题考查了离子积常数,知道离子积常数只与温度有关,与电解质溶液酸碱性无关,注意:不能根据pH确定溶液酸碱性,要根据溶液中c(H+)、c(OH-)相对大小确定溶液酸碱性,为易错点.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
已知乙烯为平面结构,因此1,2-二氯乙烯可以形成两种不同的空间异构体: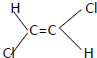 和
和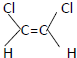 .下列各物质中,能形成类似上述两种空间异构体的是( )
.下列各物质中,能形成类似上述两种空间异构体的是( )
 和
和 .下列各物质中,能形成类似上述两种空间异构体的是( )
.下列各物质中,能形成类似上述两种空间异构体的是( )| A、1,1-二氯乙烯 |
| B、2-甲基-2-戊烯 |
| C、3-甲基-2-戊烯 |
| D、1-戊烯 |
 某期刊封面上有如下一个常见分子的球棍模型图图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图代表的有机物中含有的官能团是( )
某期刊封面上有如下一个常见分子的球棍模型图图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图代表的有机物中含有的官能团是( )| A、氨基和羧基 |
| B、碳碳双键和羧基 |
| C、碳碳双键和羟基 |
| D、氨基和醛基 |
从硫元素的化合价判断,含硫元素的下列物质只作氧化剂的是( )
| A、Na2S |
| B、S |
| C、SO2 |
| D、H2SO4 |
在一定条件下,将1mol CO和1mol水蒸气混合后发生如下变化:CO(g)+H2O(g)?CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的( )
| A、5.75倍 | B、11.5倍 |
| C、30.67倍 | D、46倍 |
下列实验操作不正确的是( )
| A、从碘水中提取单质碘,不能用无水乙醇代替CCl4 |
| B、MgCl2溶液混有少量FeCl3,加足量Mg(OH)2调pH后过滤 |
| C、用广泛pH试纸测得0.10mol?L-1 NH4Cl溶液的pH=5.2 |
| D、CO2混有少量SO2,除杂试剂和方法为:酸性KMnO4溶液、浓硫酸,洗气 |
铁和稀硫酸在敞口容器中进行反应:Fe+H2SO4=FeSO4+H2↑,下列叙述不正确的是( )
A、该反应的反应过程与能量关系可以用图表示 |
| B、若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C、若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D、若将该反应设计成原电池,负极发生的反应是:Fe-2e=Fe2+ |
在一定温度下,A2、B2、AB三种分子有如下反应发生:A2(g)+B2(g)?2AB(g),该反应达到平衡时的标志是( )
| A、容器内压强不随时间变化 |
| B、AB的生成速率与消耗速率相等 |
| C、A2、B2的浓度和AB的浓度相等 |
| D、A2、B2、AB的分子数之比为1:1:2 |
 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为