题目内容
(14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。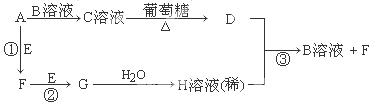
请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
Ⅰ.(1)强;(2)Cr( OH)3 H+ + CrO2—+ H2O;(3)3.0×10-6;
H+ + CrO2—+ H2O;(3)3.0×10-6;
Ⅱ.(1)极性;[Ag(NH3)2]+;
(2)4NH3+5O2 4NO+6H2O;
4NO+6H2O;
3Ag + 4H+ + NO3—= 3Ag+ + NO↑+ 2H2O
解析试题分析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,而铜与稀硫酸不反应,说明铬的活泼性强于铜。(2)Cr(OH)3和Al(OH)3类似,由Al(OH)3的酸式电离可知,Cr(OH)3的酸式电离方程式是:Cr(OH)3 H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2
H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2 4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
考点:本题考查金属活泼性的判断、方程式的书写、KsP的计算、物质的推断及化学方程式的书写。

下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| B.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
已知25℃时,AgCl的溶度积 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有 |
C.温度一定时,当溶液中 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1∶2,Sn2+转化为 (填离子符号)。
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图
所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 。
调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁。pH=4时,溶液中上述4种微粒含量最多的是 。

【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: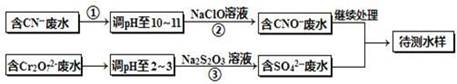
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |

 。
。 )
)
 ___pH
___pH 。(填
。(填