题目内容
11.含有较多可溶性钙镁化合物的水叫硬水,不含或含较少可溶性钙镁化合物的水叫软水.区别硬水和软水的试剂是肥皂水,现象是软水起泡沫,硬水无泡沫,长期盛硬水的容器易结垢.分析 根据硬水软水的不同点及区别方法来作答.含可溶性钙镁离子化合物的是硬水,硬水容易在盛水器具上结成水垢,我们可以用肥皂水区分软水和硬水.据此分析.
解答 解:含有较多可溶性钙镁离子化合物的水是硬水,含有较少的钙镁化合物的水为软水;鉴别软水和硬水用肥皂水,泡沫多的是软水,泡沫少的是硬水.硬水在煮沸时会产生水垢,故长期盛硬水的容器易结垢.
故答案为:钙镁;钙镁;肥皂水;软水起泡沫,硬水无泡沫;结垢.
点评 硬水和软水的区别在于可溶性的钙镁化合物的含量的高低,明确硬水和软水的不同点及区分方法是解决本题的关健.

练习册系列答案
相关题目
2.以下叙述中错误的是( )
| A. | 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 | |
| B. | 任何离子键在形成的过程中必定有电子的得与失 | |
| C. | 在氯化钠中,氯离子和钠离子靠静电作用结合 | |
| D. | 金属钠与氯气反应生成氯化钠后,体系能量降低 |
16.下列有关化学用语的表达正确的是( )
| A. | Cl-的结构示意图: | |
| B. | Na2O2的电子式为: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 丙烯的结构式:CH3CHCH2 |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、K+、SO${\;}_{4}^{2-}$、Br- | |
| B. | 含有硝酸钠的溶液:H+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO${\;}_{2}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Na+、Ca2+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ |
1.我国最早报道的超高温导体中,铊是重要组成之一.已知铊是ⅢA族元素,关于铊的性质判断正确的是( )
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |


 .
.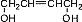 .
. .
. 等.
等.