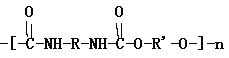题目内容
【题目】有元素X、Y、Z,已知X元素为-2价离子和Y元素为+1价离子的核外电子排布均与氖相同,Z元素最高价氧化物分子组成为Z2O3,4.5gZ元素的形成的单质与盐酸反应,在标准状况下生成5.6L氢气;Z原子核中质子数比中子数少一个。
(1)Z3+离子的结构示意图为___________Y元素位于同期表中的第_____周期,第_____族。
(2)X和Y形成的化合物有__________、_________(填化学式)其中高温下最稳定的化合物的电子式为____________。
【答案】![]() 3 IA Na2O Na2O2
3 IA Na2O Na2O2 ![]()
【解析】
Y元素的+1价阳离子的核外电子排布与氖原子相同,则Y为Na,为于元素周期表中的第3周期第IA族。X元素能生成-2价阴离子,且原子序数X<Y,则X为O,Z元素最高价氧化物组成为Z2O3,4.5gZ的单质与盐酸反应:2Z+6HCl=2ZCl3+3H2↑,在标准状况下生成5.6LH2,根据电子守恒反应的Z的物质的量为![]() ,则Z的摩尔质量为W=
,则Z的摩尔质量为W= =27,Z原子核中质子数比中子数少1个,Z的质子数为13,故Z为Al。
=27,Z原子核中质子数比中子数少1个,Z的质子数为13,故Z为Al。
(1)根据上述Z为Al,Al3+原子结构示意图为 ;Y为Na,为于元素周期表中的第3周期第IA族。答案:![]() ; 3;IA
; 3;IA
(2)根据上述X为O,Y为Na,X和Y形成的化合物有Na2O、 Na2O2,其中高温下最稳定的化合物为Na2O2,其的电子式为![]() 。答案:Na2O、 Na2O2,
。答案:Na2O、 Na2O2,![]() 。
。

练习册系列答案
相关题目