题目内容
【题目】(1)中国古代四大发明之一黑火药,它的爆炸反应为2KNO3+3C+S =A + N2↑ +3CO2↑(已配平)
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为_____________,K2O,CO2,SO2,SiO2四种晶体的熔点由高到低的顺序______________________
②生成物A的电子式为_____________。推算HCN分子中![]() 键与
键与![]() 键数目之比为_______________。
键数目之比为_______________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为__________________,1molQ2+的未成对电子数是__________个。
(3)在![]() 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为![]() (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol ![]() 的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
【答案】 O>N>C SiO2 > K2O > SO2 > CO2 K2S的电子式——略 1:1 第四周期,第VIII族 4NA [CrCl(H2O)5]2+
【解析】(1)根据原子守恒可知反应中2KNO3+3C+S=A+N2↑+3CO2↑A是K2S。则①非金属性越强,电负性越大,则非金属元素的电负性从大到小顺序依次为O>N>C;K2O是离子晶体,CO2和SO2均是分子晶体,其中SO2的相对分子质量小于CO2,SiO2是原子晶体,因此四种晶体的熔点由高到低的顺序为SiO2>K2O>SO2>CO2;②硫化钾是离子化合物,电子式为![]() 。HCN分子的结构式为H-C≡N,单键都是
。HCN分子的结构式为H-C≡N,单键都是![]() 键,三键中含有1个
键,三键中含有1个![]() 键和1个
键和1个![]() 键,因此其中
键,因此其中![]() 键与
键与![]() 键数目之比为1:1。(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,位于第四周期第VIII族;Fe元素是26号元素,Fe2+的核外电子排布式为1s22s22p63s23d6,3d能级有4个单电子,即1molFe2+的未成对电子数是4NA个。(3)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,所以x=0.003mol/0.0015mol=2,[CrCln(H2O)6-n]x+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+。
键数目之比为1:1。(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,位于第四周期第VIII族;Fe元素是26号元素,Fe2+的核外电子排布式为1s22s22p63s23d6,3d能级有4个单电子,即1molFe2+的未成对电子数是4NA个。(3)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,所以x=0.003mol/0.0015mol=2,[CrCln(H2O)6-n]x+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+。

【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
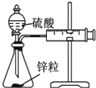
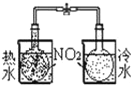
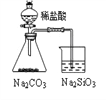
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性 C>Si |
A. A B. B C. C D. D