题目内容
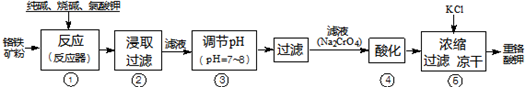
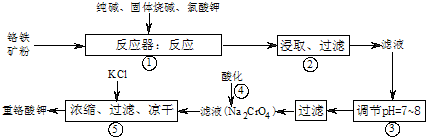
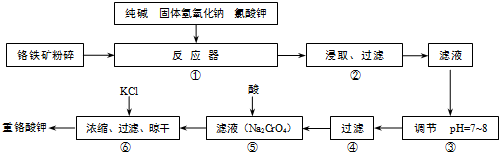
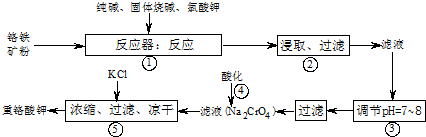
工业上常用铬铁矿(有效成份为FeO?Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾(K2Cr2O7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如图所示,涉及的主要反应是:6FeO?Cr2O3+24NaOH+7KClO3
| ||
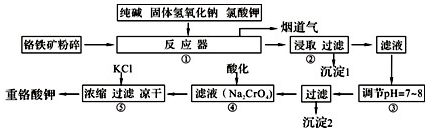
(1)⑤中溶液金属阳离子的检验方法是
(2)步骤③被沉淀的离子为(填离子符号)
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为:
(4)烟道气中的CO2可与H2合成甲醇.CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀.
①写出电解法处理废水的总反应的离子方程式
②已知Cr(OH)3的Ksp=6.3×10-31,若地表水铬含量最高限值是0.1mg/L,要使溶液中c(Cr3+)降到符合地表水限值,须调节溶液的c(OH-)≥
分析:(1)钠离子、钾离子的检验方法是焰色反应;
(2)硅酸钠和偏铝酸钠易发生水解,根据水解平衡移动原理来回答;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(4)利用盖斯定律计算反应热,并书写热化学方程式;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-将亚铁离子氧化为铁离子反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,把以上方程式加合可得电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②根据Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-)计算.
(2)硅酸钠和偏铝酸钠易发生水解,根据水解平衡移动原理来回答;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(4)利用盖斯定律计算反应热,并书写热化学方程式;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-将亚铁离子氧化为铁离子反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,把以上方程式加合可得电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②根据Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-)计算.
解答:解:(1)⑤中溶液金属阳离子为钠离子、钾离子,检验方法是焰色反应,故答案为:焰色反应;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,故答案为:SiO32-,AlO2-;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO2+Na2CO3
Na2SiO3+CO2,故答案为:SiO2+Na2CO3
Na2SiO3+CO2;
(4)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
×②-①×
;所以△H=×
(-571.6kJ/mol)-(-1451kJ/mol)×
=-131.9kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ/mol;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,都将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,综上可得:电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑,故答案为:6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②,若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=
mol/L,要使溶液中c(Cr3+)降到符合地表水限值,已知Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-),须调节溶液的c(OH-)≥
mol/L,故答案为:
.
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,故答案为:SiO32-,AlO2-;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO2+Na2CO3
| ||
| ||
(4)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ/mol;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,都将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,综上可得:电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑,故答案为:6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②,若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=
| 1×10-4 |
| 52 |
|
|
点评:本题考查较为综合,涉及氧化还原反应、电解、盖斯定律、化学计算、物质检验等,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.

练习册系列答案
相关题目
 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀