题目内容
在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH 降低,应采取的措施是
A.加热 B.加少量盐酸 C.加少量醋酸钠晶体 D.加少量水
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应:
N2(g)+3H2(g) 2NH3(g) △H=-93 kJ/mol。
2NH3(g) △H=-93 kJ/mol。
试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
化学键 | H-H | N-H | N≡N |
键kJ/mol | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变△H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。
(4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。
在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在_______式滴定管内,原因是(文字叙述并用有关离子方程式表示): ;若用甲基橙作指示剂,达到滴定终点时,溶液从_______色变为_______色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第______种(填序号)。
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
根据以上数据计算时应带入的Na2CO3溶液体积为_________,求这种待测盐酸的物质的量浓度(用数据和符号列式即可):C(HCl)=_________ 。
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______(填“偏高”、“偏低”或“无影响”)。


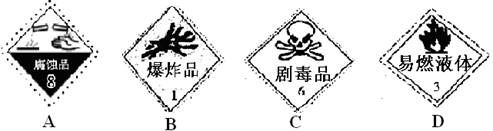
 2C(g)+D(s) △H<0,下列叙述正确的是
2C(g)+D(s) △H<0,下列叙述正确的是