题目内容
【题目】已知:(X代表卤素原子,R代表烃基) 
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)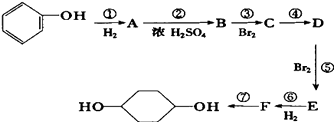
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D
(2)反应①~⑦中属于消去反应的是(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
【答案】
(1)![]() ;
;![]()
(2)②④
(3)![]()
(4)![]()
【解析】解: ![]() 与氢气发生加成反应可生成A,A为
与氢气发生加成反应可生成A,A为 ![]() ,在浓硫酸作用下发生消去反应,B为
,在浓硫酸作用下发生消去反应,B为 ![]() ,与溴发生加成反应,C为
,与溴发生加成反应,C为 ![]() ,由D发生加成反应可知D中含有碳碳双键,应为C的消去反应产物,为
,由D发生加成反应可知D中含有碳碳双键,应为C的消去反应产物,为 ![]() ,由产物可知E为
,由产物可知E为 ![]() ,则F为
,则F为 ![]() ,(1)由 以上分析可知B为
,(1)由 以上分析可知B为 ![]() ,D为
,D为 ![]() ,所以答案是:
,所以答案是: ![]() ;
; ![]() ;(2)①为加成反应,②为消去反应,③加成反应,④为消去反应,⑤为加成反应,⑥为加成反应,⑦为取代反应,
;(2)①为加成反应,②为消去反应,③加成反应,④为消去反应,⑤为加成反应,⑥为加成反应,⑦为取代反应,
所以答案是:②④;(3)如果不考虑⑥、⑦反应,对于反应⑤, ![]() 可与溴发生1,2加成,1,4加成或完全加成,得到的E可能为
可与溴发生1,2加成,1,4加成或完全加成,得到的E可能为 ![]() ,
,
所以答案是: ![]() ;(4)C为
;(4)C为 ![]() ,发生消去反应可生成D,反应的方程式为
,发生消去反应可生成D,反应的方程式为 ![]() ,
,
所以答案是:  .
.

【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性.
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 |
(1)对实验Ⅰ进行研究②④ ①实验Ⅰ中生成红色物质的离子方程式为:
②经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:
③请写出60s后反应进一步加快可能的原因(写出两条)
(2)对实验Ⅱ进行研究 实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42﹣对Al与Cu2+的置换反应存在一定的抑制作用.
假设二:
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
实验Ⅵ的设计目的是:
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:
(4)请设计实验证明Cl﹣对Al与H+的反应同样起到相似的作用: