题目内容
【题目】800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由 图分析不能得出的结论是( )

A. a是反应物
B. 正反应是一个体积扩大的反应
C. 若升高温度,a的转化率增大
D. 若增大压强,a的转化率减小
【答案】C
【解析】根据图象可知,达到平衡时a的浓度减小2mol/L,b的浓度增大2 mol/L,c的浓度增大1 mol/L,因反应物浓度的变化量之比等于其化学计量数之比,则该反应的方程式为:2a(g) ![]() 2b(g)+c(g)。A. 根据分析可知,a为反应物,故A正确;B. 根据反应方程式可知,该反应的正反应方向是体积扩大的反应,故B正确;C. 根据图象无法判断该反应是吸热反应还是放热反应,所以无法判断温度对a的转化率的影响,故C错误;D. 该反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,则a的转化率减小,故D正确;答案选C。
2b(g)+c(g)。A. 根据分析可知,a为反应物,故A正确;B. 根据反应方程式可知,该反应的正反应方向是体积扩大的反应,故B正确;C. 根据图象无法判断该反应是吸热反应还是放热反应,所以无法判断温度对a的转化率的影响,故C错误;D. 该反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,则a的转化率减小,故D正确;答案选C。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
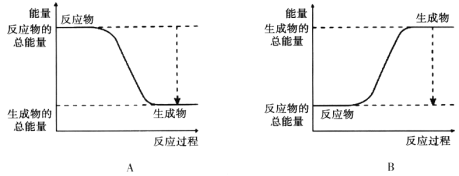
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。