题目内容
3.将11.1克某化合物R溶于水配制成200mL溶液,所得溶液的物质的量浓度为0.5mol•L-1,则化合物R的摩尔质量为( )| A. | 55.5 | B. | 111 | C. | 111g/mol | D. | 55.5 g/mol |
分析 根据公式c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$来计算即可.
解答 解:设:化合物R的摩尔质量M,则0.5mol/L=$\frac{\frac{11.1g}{M}}{0.2L}$,解得M=111g/mol.
故选C.
点评 本题考查学生物质的量浓度的有关计算等知识,属于基本知识的考查,注意公式的理解和应用是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.可以说明NH3分子是极性分子的理由( )
| A. | NH3中含有的3个N-H键是等同的 | B. | NH3中N-H键之间的夹角为107°18′ | ||
| C. | NH3分子空间构型为三角锥形 | D. | NH3的熔点比水的熔点低 |
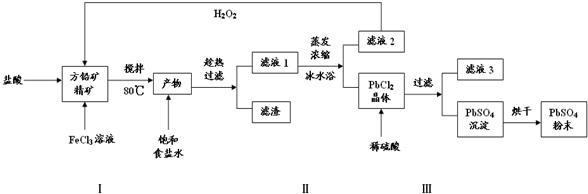
18.2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失.据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN).下列有关氰化钠的说法中错误的是( )
| A. | NaCN中碳元素的化合价为+4 | |
| B. | NaCN易溶于水,其水溶液呈碱性 | |
| C. | 可用强氧化剂如H2O2等将NaCN氧化为无毒物质 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
8.下列各组离子在无色酸性溶液中能大量共存的是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
13.下列实验操作不正确的是( )
| A. | 用量筒量取25.0mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3固体试样 | D. | 用托盘天平称量NaCl固体5.8g |
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$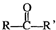 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或 .
.