题目内容
15. (1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为
(1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为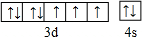 .
.(2)若en代表乙二胺(
 ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在.它们的结构简式如下,指出Be的杂化轨道类型.
①Cl-Be-Clsp
②
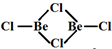 sp2
sp2③
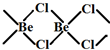 sp3
sp3(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜.它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得.BP晶胞如图所示.
①画出三溴化硼和三溴化磷的空间结构式.
三溴化硼
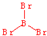
三溴化磷

②在BP晶胞中B的堆积方式为面心立方最密堆积.
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离$\frac{239\sqrt{3}}{2}$.
分析 (1)27号元素原子核外电子排布为1s22s22p63s23p63d74s2,其价电子的轨道排布式为3d74s2,根据泡利原理、洪特规则画出价电子排布图;
(2)配合物[Pt(en)2]Cl4中心离子与N原子形成配位键;
(3)①Be原子形成2个Be-Cl键,没有孤对电子,杂化轨道数目为2;
②Be原子形成3个B-Cl键,没有孤对电子,杂化轨道数目为3;
③Be原子形成4个B-Cl键,没有孤对电子,杂化轨道数目为4;
(4)①三溴化硼分子中硼原子的价层电子对数为3+$\frac{3-1×3}{2}$=3,没有孤电子对,所以分子空间构型为平面三角形,三溴化磷分子中磷原子的价层电子对数为3+$\frac{5-1×3}{2}$=4,P原子有一对孤电子对,所以分子空间构型为三角锥形;
②由晶胞结构可知,在BP晶胞中B的堆积方式为面心立方最密堆积;
③P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的$\frac{1}{4}$.
解答 解:(1)27号元素原子核外电子排布为1s22s22p63s23p63d74s2,处于第四周期第Ⅷ族,其价电子的轨道排布式为3d74s2,价电子排布图为 ,
,
故答案为:第四周期第Ⅷ族; ;
;
(2)配合物[Pt(en)2]Cl4中心离子与N原子形成配位键,中心离子的配位原子数为4,故答案为:4;
(3)①Be原子形成2个Be-Cl键,没有孤对电子,杂化轨道数目为2,Be原子杂化方式为sp;
②Be原子形成3个B-Cl键,没有孤对电子,杂化轨道数目为3,Be原子杂化方式为sp2;
③Be原子形成4个B-Cl键,没有孤对电子,杂化轨道数目为4,Be原子杂化方式为sp3,
故答案为:sp;sp2;sp3;
(4)①三溴化硼分子中硼原子的价层电子对数为3+$\frac{3-1×3}{2}$=3,没有孤电子对,所以分子空间构型为平面三角形,结构式为 ,
,
三溴化磷分子中磷原子的价层电子对数为3+$\frac{5-1×3}{2}$=4,P原子有一对孤电子对,所以分子空间构型为三角锥形,结构式为 ,
,
故答案为: ;
; ;
;
②由晶胞结构可知,在BP晶胞中B的堆积方式为面心立方最密堆积,故答案为:面心立方最密堆积;
③P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的$\frac{1}{4}$,立方体的每条边长为478pm,则晶胞体对角线长为$\sqrt{3}$×478pm,则P原子与B原子最近距离为$\sqrt{3}$×478pm×$\frac{1}{4}$=$\frac{239\sqrt{3}}{2}$pm,
故答案为:$\frac{239\sqrt{3}}{2}$.
点评 本题是对物质结构的考查,涉及核外电子排布、配合物、杂化方式判断、分子结构、晶胞结构与计算等,(4)中晶胞中原子距离计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
| A. | NH4Cl晶体受热分解 | B. | 木炭燃烧 | ||
| C. | 钠与水反应 | D. | 酸碱中和反应 |
| A. | 烧碱溶液 | B. | 硝酸 | C. | 氢氟酸 | D. | 水玻璃 |
| A. | 75% | B. | 25% | C. | 79.1% | D. | 78.1% |
| 氧化反应一定属于化合反应 | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| 生成盐和水的反应一定是中和反应 | Ca(OH)2+CO2═CaCO3↓+H2O |
| 只有在加热或高温条件下才能冶炼出金属 | Fe+CuSO4═FeSO4+Cu |
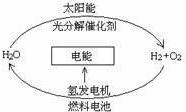
| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
| A. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |