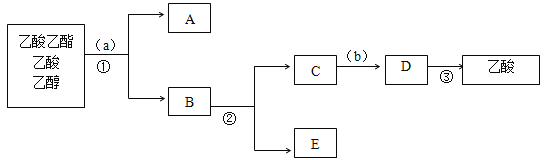
��Ŀ����
����Ŀ��ijʵ��С��ͨ���������ᷴӦ��ʵ�飬�о�Ӱ�췴Ӧ���ʵ�����(����������ȣ��������״һ�������������)�����ʵ�����±���
ʵ���� | ����Ũ��/(mol/L) | ������̬ | �¶�/K |
1 | 4.00 | ��״ | 293 |
2 | 4.00 | ��ĩ | 293 |
3 | 2.00 | ��״ | 293 |
4 | 2.00 | ��ĩ | 313 |
(1)������ʵ�����Ӧ����1����(����ʣ��)��������ʵ����Ҫ�����������______��
(2)ʵ��___��_____(��ʵ����)���о������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻ʵ��1��2���о�_______�Ը÷�Ӧ���ʵ�Ӱ�졣
(3)�ⶨ�ڲ�ͬʱ������������V�����ݣ����Ƴ�ͼ�ף�������c��d�ֱ��Ӧ��ʵ����������______��______��

(4)��������һ��ʵ�飬���ֲ���������������ʱ��仯�����ͼ����ʾ��
������t1��t2���ʱ仯����Ҫԭ����______��
��t2��t3���ʱ仯����Ҫԭ����___________ ��
(5)ʵ��1�����������������е�����a������ij�Լ���ʹ����a��Ϊ����b����______��
A.CuO��ĩ B.NaNO3���� C.NaCl��Һ D.ŨH2SO4
���𰸡� ��Ӧ����1�����ռ������������ 1 3 ���������Ĵ�С������������̬�� 1 3 �������ᷴӦ�Ƿ��ȷ�Ӧ���¶����ߣ���ѧ��Ӧ���ʼӿ� ���ŷ�Ӧ�IJ��Ͻ��У������Ũ�����ͣ���ѧ��Ӧ���ʼ��� D
����������1���ȽϷ�Ӧ������Ҫ�ⶨ��ͬʱ���ڲ��������������
��2���о������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ����Ҫ���������������䣻ʵ��1��2��������״��ͬ��
��3��������������Է�Ӧ���ʵ�Ӱ������жϣ�
��4��������������Է�Ӧ���ʵ�Ӱ������жϣ�
��5������a��Ϊ����b��Ӧ���ʼӿ죬�������������䣬�ݴ˽��
��1���������ᷴӦ�����Ȼ�������������������ʵ�����Ӧ����1����(����ʣ��)��������ʵ����Ҫ����������Ƿ�Ӧ����1�����ռ��������������
��2��Ҫ�о������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ����Ҫ���������������䣬����ݱ������ݿ�֪ʵ��1��3���о������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻ʵ��1��2�еı�����������״���������о����������Ĵ�С������������̬���Ը÷�Ӧ���ʵ�Ӱ�졣
��3������c��d��Ȳ���������һ���࣬��d����Ҫ��ʱ����࣬˵����Ӧ�������������������¶ȡ�����������Ũ�Ⱦ����Լӿ췴Ӧ���ʣ���˸��ݱ������ݿ�֪����c��d�ֱ��Ӧ��ʵ����������1��3��
��4���������������ᷴӦ�Ƿ��ȷ�Ӧ���¶����ߣ���ѧ��Ӧ���ʼӿ죬����t1��t2����������
������Ϊ���ŷ�Ӧ�IJ��Ͻ��У������Ũ�����ͣ���ѧ��Ӧ���ʼ���������t2��t3������С��
��5������ͼ���֪����a��Ϊ����b��Ӧ���ʼӿ죬�������������䣬��A.����CuO��ĩ�����ᷴӦ�����Ȼ�ͭ�����û���ͭ����ԭ��أ���Ӧ���ʼӿ죬����������������������ɵ�����������٣�A����B.����NaNO3���壬������Һ���൱�������ᣬ���������������������Ӧ�ò���������B����C.����NaCl��Һ�൱��ϡ�ͣ���Ӧ���ʼ�С��C����D.��������ŨH2SO4������Ũ������Ӧ���ʼӿ죬D��ȷ����ѡD��

����Ŀ��ʯ�Ͳ�Ʒ�г�����H2S�⣬�����и�����̬���л�����COS��CH3SH�ȡ�
�ش��������⣺
��1��CH3SH�������ĵ���ʽΪ__________��
��2��CO��H2S��Ӧ�ɲ����ʻ���( COS)����һ�����ܱ������з�����Ӧ��CO(g)+H2S(g)![]() COS(g)+H2(g)���ﵽƽ�⣬�������±���ʾ��
COS(g)+H2(g)���ﵽƽ�⣬�������±���ʾ��
ʵ�� | �¶�/�� | ��ʼʱ | ƽ��ʱ | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
�ٸ÷�Ӧ��________��Ӧ������ȡ����ȡ�����
��ʵ��1��ƽ��ʱ��CO��ת����Ϊ_______��
��ʵ��2�ﵽƽ��ʱ��a_______7.0�����������С�ڡ����ڡ�����
��ʵ��3��ƽ����ٳ���1.0 molH2��ƽ�ⳣ��ֵ____�������������С�����䡱����
��3��COS�Ǵ�����Ⱦ���������Һ�п���H2O2����COS����һ��ǿ�������ѳ���Ӧ�Ļ�ѧ����ʽΪ_______________��
��4����һ��������Ϊ�����K2CO3һ����˹����
��K2CO3��Һ����H2S�ķ�ӦΪK2CO3 +H2S =KHS +KHCO3���÷�Ӧ��ƽ�ⳣ���Ķ���ֵΪlgK=_____����֪��H2CO3 lgK1=-6.4��lgK,2=- 10.3��H2S lgKl=-7.0��lgK2
����֪�����Ȼ�ѧ����ʽ��
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) ��H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) ��H2 = 632 kJ/mol
����˹��������ķ�ӦΪSO2��H2S���巴Ӧ����S(s)����÷�Ӧ���Ȼ�ѧ����ʽΪ_________��