题目内容
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. 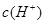 B.
B.
 C.
C.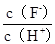 D.
D. 
【答案】
D
【解析】略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
题目内容
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. 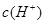 B.
B.
 C.
C.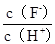 D.
D. 
D
【解析】略

 阅读快车系列答案
阅读快车系列答案