题目内容
在反应2MnO4-+5H2S+6H+═2Mn2++5S↓+8H2O中,电子转移的总数为________,还原剂为________,还原产物为________,当反应中有80gS析出时,有________mol MnO4-被________,同时有________ g H2S被________.
10e- H2S Mn2+ 1 还原 85 氧化
分析:2MnO4-+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7-2)e-,S元素的化合价由-2价升高为0,含元素化合价升高的物质为还原剂,氧化剂对应的产物为还原产物;该反应中生成5molS时,2molMnO4-被还原,5molH2S被氧化,以此来解答.
解答:2MnO4-+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7-2)e-,=10e-,
S元素的化合价由-2价升高为0,则H2S为还原剂,
MnO4-为氧化剂,对应的产物Mn2+为还原产物;
该反应中生成5molS时,2molMnO4-被还原,5molH2S被氧化,
80gS的物质的量为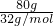 =2.5mol,
=2.5mol,
则有1molMnO4-被还原,2.5molH2S被氧化,2.5molH2S的质量为2.5mol×34g/mol=85g,
故答案为:10e-;H2S;Mn2+;1;还原;85;氧化.
点评:本题考查氧化还原反应的计算,明确氧化还原反应中的元素的化合价变化及氧化还原反应中的基本概念即可解答,注意物质的量与转移电子数的关系,题目难度不大.
分析:2MnO4-+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7-2)e-,S元素的化合价由-2价升高为0,含元素化合价升高的物质为还原剂,氧化剂对应的产物为还原产物;该反应中生成5molS时,2molMnO4-被还原,5molH2S被氧化,以此来解答.
解答:2MnO4-+5H2S+6H+═2Mn2++5S↓+8H2O中,Mn元素由+7价降低为+2价,该反应中转移2×(7-2)e-,=10e-,
S元素的化合价由-2价升高为0,则H2S为还原剂,
MnO4-为氧化剂,对应的产物Mn2+为还原产物;
该反应中生成5molS时,2molMnO4-被还原,5molH2S被氧化,
80gS的物质的量为
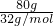 =2.5mol,
=2.5mol,则有1molMnO4-被还原,2.5molH2S被氧化,2.5molH2S的质量为2.5mol×34g/mol=85g,
故答案为:10e-;H2S;Mn2+;1;还原;85;氧化.
点评:本题考查氧化还原反应的计算,明确氧化还原反应中的元素的化合价变化及氧化还原反应中的基本概念即可解答,注意物质的量与转移电子数的关系,题目难度不大.

练习册系列答案
相关题目

 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.