题目内容
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 | B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 | D.溶液的pH增大 |
A
解析试题分析:A. 向0.1 mol·L-1 CH3COOH溶液中加少量水,使电离平衡CH3COOH CH3COO-+H+向电离的方向移动。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以C(H+)的浓度减小。因为在一定条件下C(H+)·C(OH-)=Kw,故C(OH-)增大。错误符合题意。B. B.加水使平衡向电离的方向移动,CH3COOH电离的分子数目增加,总分子数不变,所以电离程度变大。正确但不符合题意。C.因为加水对醋酸溶液来说起到稀释作用,使整个溶液中醋酸电离产生的氢离子浓度减小,对水的电离的抑制作用减小,所以水的电离程度增大。正确但不符合题意。D.加水稀释,使溶液中的氢离子浓度减小。氢离子的浓度越小,溶液的PH就越大。故溶液的PH增大。正确但不符合题意。选项为A。
CH3COO-+H+向电离的方向移动。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以C(H+)的浓度减小。因为在一定条件下C(H+)·C(OH-)=Kw,故C(OH-)增大。错误符合题意。B. B.加水使平衡向电离的方向移动,CH3COOH电离的分子数目增加,总分子数不变,所以电离程度变大。正确但不符合题意。C.因为加水对醋酸溶液来说起到稀释作用,使整个溶液中醋酸电离产生的氢离子浓度减小,对水的电离的抑制作用减小,所以水的电离程度增大。正确但不符合题意。D.加水稀释,使溶液中的氢离子浓度减小。氢离子的浓度越小,溶液的PH就越大。故溶液的PH增大。正确但不符合题意。选项为A。
考点:考查弱电解质的水溶液中加水对电解质的电离、水的电离及溶液的酸碱性、离子浓度的影响的知识。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
| A.水可以电离出离子,所以是强电解质 |
| B.水的离子积可表示KW=c(H+)·c(OH-) |
| C.常温下水中的c(H+)大于c(OH-) |
| D.升高温度,c(H+)增大,显弱酸性 |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
实验:①1 mol·L–1AgNO3溶液和0.1 mol·L–1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c; ②向滤液b中滴加0.1 mol·L–1KI溶液,出现浑浊; ③向沉淀c中滴加0.1 mol·L–1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+ (aq)+Cl–(aq) Ag+ (aq)+Cl–(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: p(M2+)=-lg c(M2+),p(CO32-)=-lg c(CO32-)。下列说法正确的是 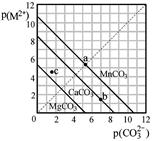
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C.b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D.c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是
| A.CH3 COOH的电离平衡常数增大为原来的10倍 |
| B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍 |
| C.CH3 COO一与H十的浓度之积减小为原来的0.1 |
| D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1 |
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4×10-7 |
| K2=6×10-11 |
A.向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2=Cl-+ClO-+2CO2↑+H2O
C.向NaClO溶液中通少量CO2:CO2+NaClO+H2O=NaHCO3+HClO
D.向NaClO溶液中通过量CO2:CO2+2NaClO+H2O=Na2CO3+2HClO
下列表述正确的是
| A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa) |
| D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
以下物理量只与温度有关的是
| A.醋酸的电离度 | B.醋酸钠的水解程度 |
| C.水的离子积 | D.氨气的溶解度 |