题目内容
40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合,混合后测得溶液的温度为32.6℃。求反应的中和热[混合后溶液的比热容c =" " 4.18 J/(g·℃)]。
反应的中和热为56.85 kJ/ mol 。
酸碱中和反应是放热反应,反应放出的热量可通过反应前后体系温度的变化来计算:Q = -cm(T2-T1)。中和热是在稀溶液中,1mol的H+和1mol OH-发生中和反应生成1molH2O的水时所放出的热量。稀溶液的密度接近于溶剂水的。
⑴此稀溶液反应放出的热量为::Q = cm(T2-T1)=" 4.18" J/(g·℃)×(40mL+40mL)×1g/mL×(32.6℃-19℃)=" 4547.84" J 。
⑵求反应的中和热:
依据 HCl + NaOH = NaCl + H2O
混合前 0.08 mol 0.08 mol 0 mol 0 mol
混合后 0 mol 0 mol 0.08 mol 0.08 mol
又依据生成0.08 mol水放出热量 4547.84 J ,生成1 mol水放出热量为:
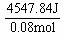 = 56.85 kJ/ mol
= 56.85 kJ/ mol
⑴此稀溶液反应放出的热量为::Q = cm(T2-T1)=" 4.18" J/(g·℃)×(40mL+40mL)×1g/mL×(32.6℃-19℃)=" 4547.84" J 。
⑵求反应的中和热:
依据 HCl + NaOH = NaCl + H2O
混合前 0.08 mol 0.08 mol 0 mol 0 mol
混合后 0 mol 0 mol 0.08 mol 0.08 mol
又依据生成0.08 mol水放出热量 4547.84 J ,生成1 mol水放出热量为:
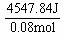 = 56.85 kJ/ mol
= 56.85 kJ/ mol 
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 NH4Cl(s)
NH4Cl(s)
 C(s) =
C(s) = 
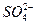 (aq)+
(aq)+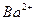 (aq)+2OH
(aq)+2OH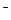 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H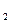 O(1);
O(1);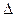 H=
H=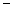 57.3 kJ/mol
57.3 kJ/mol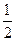 H
H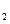 O(I);
O(I);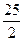 O
O