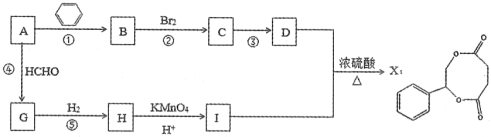
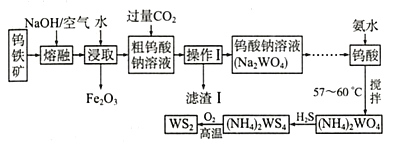
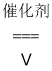题目内容
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。
(2)下列物质中,能吸收SO2的有_______(填序号)。
a.氨水 b.酸性KMnO4溶液 c.生石灰 d.Na2CO3溶液
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收废气中的SO2并制备(NH4)2SO3·H2O,过程如下:
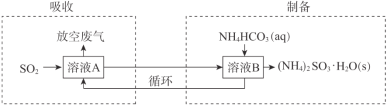
①“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3物质的量之比变_____(填“大”或“小”)。
②“制备”过程中,溶液B中发生反应的化学方程式是 _____________________。
③检验产品(NH4)2SO3·H2O中含有少量SO42-的方法如下:取少量产品加水溶解,(将实验操作和现象补充完整)___________________________________。
(4)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
4N2(g)+6H2O(g) ΔH= -1627 kJmol-1
①被NO氧化的NH3和被O2氧化的NH3的物质的量之比为________________。
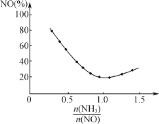
②氨氮比![]() 会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率如图为350 ℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是__________________。
>1.0时,烟气中NO含量反而增大,主要原因是__________________。
【答案】0.32 abcd 小 NH4HCO3 + NH4HSO3= (NH4)2SO3·H2O↓+ CO2↑ 加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生 2:1 过量的NH3和O2反应生成NO(或4NH3+5O2=4NO+6H2O)
【解析】
(1)根据硫元素质量守恒计算;
(2)根据SO2的性质分析;
(3)将烟气通入(NH4)2SO3和NH4HSO3的混合溶液A,(NH4)2SO3吸收SO2得到溶液B:NH4HSO3,将NH4HCO3与溶液B混合得到(NH4)2SO3H2O,
①吸收过程的反应为:SO2+H2O+(NH4)2SO3=2NH4HSO3,据此分析;
②制备过程为NH4HCO3与溶液B NH4HSO3混合得到(NH4)2SO3H2O的反应;
③SO42-用酸化的氯化钡溶液检验,考虑排除亚硫酸根的干扰。
(4)①根据平衡常数的定义书写即可;从方程可知,4mol NH3被氧化为N2,失去电子为12mol,得到12mol电子的是4mol NO和1mol O2,其中4mol NO得电子8mol,1mol O2得电子4mol,据此计算;
②氨气与氧气的反应生成NO,据此分析;
(1)燃煤8亿吨,煤中含硫质量分数以2%,则硫元素的质量为0.16亿吨,产生的SO2中硫元素也为0.16亿吨,则m(SO2)×![]() =0.16,解得m(SO2)=0.32亿吨;
=0.16,解得m(SO2)=0.32亿吨;
(2)SO2为酸性氧化物,能与碱性溶液和碱性氧化物反应,氨水、Na2CO3溶液、生石灰均可吸收SO2,SO2同时具有还原性,能被强氧化剂酸性KMnO4溶液吸收;
故答案为:abcd;
(3)①吸收过程的反应为:SO2+H2O+(NH4)2SO3=2NH4HSO3,随着吸收,(NH4)2SO3转化,越来越少,NH4HSO3增多,(NH4)2SO3和NH4HSO3物质的量之比变小;
②溶液B中发生反应的化学方程式是:NH4HCO3 +NH4HSO3═(NH4)2SO3H2O↓+CO2↑;
③检验产品(NH4)2SO3H2O中含有少量SO42-,应先加酸除去亚硫酸根的干扰,再用氯化钡溶液检验,故方法为:取少量产品加水溶解,加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生;
(4)①反应4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g),从方程可知,4mol NH3被氧化为N2,失去电子为12mol,得到12mol电子的是4mol NO和1mol O2,其中4mol NO得电子8mol,1mol O2得电子4mol,故其中被NO和O2氧化的NH3的比例为2:1;
②当氨氮比![]() >1.0时,过量的氨气与氧气的反应生成NO,化学反应为4NH3+5O2=4NO+6H2O,所以烟气中NO浓度增大,烟气中NO含量增大。
>1.0时,过量的氨气与氧气的反应生成NO,化学反应为4NH3+5O2=4NO+6H2O,所以烟气中NO浓度增大,烟气中NO含量增大。

 阅读快车系列答案
阅读快车系列答案【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()
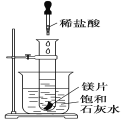
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
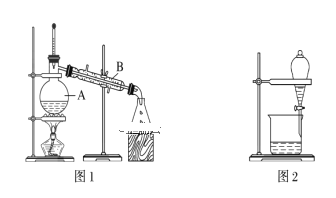
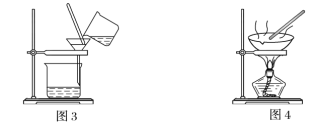
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是_______________________。下列关于以上实验操作说法一定正确的是_____。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。