题目内容
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法 B加热分解 C结晶法 D分液法 E蒸馏法 F过滤法
(1) 分离饱和食盐水和沙子的混合物;
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3) 分离水和苯的混合物;
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某化学实验小组需要1mol·L-1的CuSO4溶液90ml,现用CuSO4·5H2O晶体来配制,请回答下列问题:
(1)实验时,应用托盘天平称取CuSO4·5H2O晶体 g。
(2)配制过程中,不需要的仪器(填序号) 。
A药匙 B量筒 C烧杯 D玻璃棒 E蒸发皿
完成实验还缺少的玻璃仪器是 。
(3)定容时的操作:当液面接近容量瓶刻度线时, ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)下列操作会使配得的CuSO4溶液浓度偏高的是________。
A.CuSO4·5H2O已失去部分结晶水 |
B.定容时仰视容量瓶的刻度线 |
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
E.容量瓶内壁附有水珠而未干燥处理
(1)根据计算用托盘天平需称取氯化钠_________ g;
(2)配制溶液时,除需要烧杯、玻璃棒外,还必须用到的玻璃仪器有 ;
(3)配制溶液有下列几步操作:a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容.正确的操作顺序是 ;
(4)下列操作结果使溶液物质的量浓度偏低的是___ ______ ;
A.没有将洗涤液转入容量瓶中 |
B.加水定容时,水的量超过了刻度线 |
C.定容时,俯视容量瓶的刻度线 |
D.容量瓶洗涤后,未经干燥处理 |
(5)取出该NaCl溶液10mL加水稀释到200mL,稀释后溶液中NaCl的物质的量浓度是_________


 B.
B. 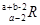 C.
C.  D.
D. 
 2Z(g)+M(s),5min后达到平衡,此时生成0.2 mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成0.2 mol Z。下列说法正确的是 2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是 aClO3转移6mol的电子
aClO3转移6mol的电子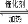 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol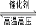 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol