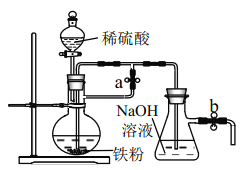
��Ŀ����
����Ŀ����֪NO2��N2O4���ת����2NO2(g)![]() N2O4(g)����H����24.2 kJ��mol��1���ں����£���һ����NO2��N2O4(g)�Ļ������������Ϊ2 L���ܱ������У��������ʵ���Ũ����ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������������������(���� )
N2O4(g)����H����24.2 kJ��mol��1���ں����£���һ����NO2��N2O4(g)�Ļ������������Ϊ2 L���ܱ������У��������ʵ���Ũ����ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������������������(���� )

A. ǰ10 min�ڣ���v(NO2)��ʾ�ķ�Ӧ����Ϊ0.04 mol��L-1��min-1
B. ��Ӧ���е�10 minʱ����ϵ�ų�������Ϊ9.68 kJ
C. a������Ӧ����С���淴Ӧ����
D. 25 minʱ������Ӧ��������
���𰸡�B
����������ͼ��֪10-25minΪƽ��״̬��b���������ߵ�Ũ��������Ϊ��0.6-0.2��mol/L=0.4mol/L��a���������ߵ�Ũ�ȼ�����Ϊ��0.6-0.4��mol/L=0.2mol/L��b���������߱�ʾ���������Ũ�ȱ仯����a���������߱�ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������b���������߱�ʾNO2Ũ����ʱ��ı仯���ߣ�a���������߱�ʾN2O4Ũ����ʱ��ı仯���ߣ���ӦʱNO2Ũ������N2O4Ũ�ȼ�С��˵����Ӧ���������
A����ͼ���֪��10 min��NO2��Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L����v��NO2��=![]() =0.04mol/��Lmin������A��ȷ��
=0.04mol/��Lmin������A��ȷ��
B����ͼ��֪10-25minΪƽ��״̬ʱ����Ӧ���ĵ�N2O4Ũ��Ϊ0.2mol/L���������ʵ���Ϊ0.2mol/L��2L=0.4mol����Ӧ������У�Ҫ������������Ӧ���յ�����Ϊ��0.4mol��24.2kJ/mol=9.68 kJ������ϵ���յ�������9.68 kJ�����Ƿų�������Ϊ9.68 kJ����B������
C������ͼ���֪���÷�Ӧ��10minʱ�ﵽƽ��״̬���������������֪��10min֮ǰNO2Ũ������N2O4Ũ�ȼ�С��˵����Ӧ�������������a������Ӧ����С���淴Ӧ���ʣ���C��ȷ��
D������ͼ���֪��25minʱ�ı仯��������NO2��Ũ������������Ӧ��������D��ȷ��
���Դ����ѡB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�