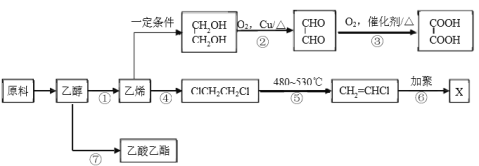
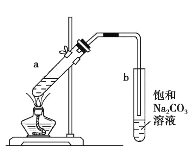
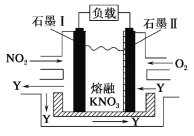
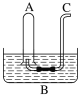
题目内容
【题目】向新制氯水中逐滴滴加NaOH溶液,溶液pH随时间的变化如图所示。呈碱性时停止滴加,一段时间后溶液黄绿色逐渐褪去。由此得不到的结论是
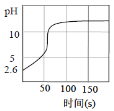
A.该新制氯水c(H+)=10-2.6mol/L
B.开始阶段,pH迅速上升说明H+被中和
C.OH-和Cl2能直接快速反应
D.NaOH和氯水反应的本质是OH-使Cl2+H2O![]() H++Cl-+HClO平衡右移
H++Cl-+HClO平衡右移
【答案】C
【解析】
A. 没有加入NaOH溶液时,新制氯水的pH为2.6,氢离子的浓度c(H+)=10-2.6mol/L,故A正确;
B. 向新制氯水中逐滴滴加NaOH溶液,NaOH先和溶液中的氢离子反应,pH迅速上升,故B正确;
C. 新制氯水中有氢离子,逐滴滴加NaOH溶液,NaOH先和溶液中的氢离子和HClO反应,故C错误;
D. 由图可知,逐滴滴加NaOH溶液,NaOH先和溶液中的氢离子和HClO反应,使Cl2+H2O![]() H++Cl-+HClO反应平衡右移,故D正确;
H++Cl-+HClO反应平衡右移,故D正确;
题目要求选择不能得到的结论,故选C。

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
【题目】
序列 | 参加反应的物质 | 生成物 | |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… | |
② | Cl2、FeBr2 | 只有FeCl3、FeBr3 | |
③ | KClO3、HCl(浓) | Cl2…… |
根据上表中信息判断,下列选项正确的是( )
A.氧化性由强到弱顺序为KClO3>Cl2>Fe3+>Br2
B.第②组反应中Cl2与FeBr2的物质的量之比为1:1
C.第③组反应中生成1molCl2,转移电子2mol
D.第①组反应的其余产物为H2O和O2