题目内容
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。
.(1)CH3OH(l)+3/2 O2(g)= CO2(g)+2H2O(l) ΔH=-4QKJ/mol
(2)-93。 (3)2C(s,石墨)+H2(g)=C2H2(g)
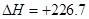 KJ/mol
KJ/mol
【解析】
试题解析:(1) 燃烧热是1 mol可燃物完全燃烧生成稳定氧化物释放的热量。8g CH3OH燃烧放热Q kJ,则1 molCH3OH完全燃烧放热4Q kJ.所以CH3OH(l)+ O2(g)= CO2(g)+2H2O(l) ΔH=-4QKJ/mol;(2) ΔH=反应物的键能总和-生成物的键能总和=(945+3×436)kJ/mol -2×3×391 kJ/mol =-93 kJ/mol,即a=-93。(3) :C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol ③
由 (①×4+ ②-③)/2得2C(s,石墨)+H2(g)=C2H2(g)
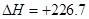 KJ/mol
KJ/mol
考点:盖斯定律的应用和热化学方程式的书写

(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。