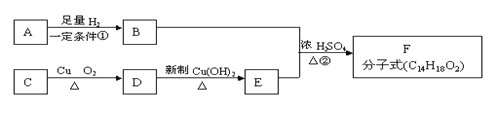
题目内容
【题目】乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为_____________;
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)

①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g)![]() C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) △H=______kJ·mol-1
C2H2(g)+3H2(g) △H=______kJ·mol-1
(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g)![]() C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g)![]() C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。

①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为_______;
②1725℃时,反应2CH4(g)![]() C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
【答案】 C2H2-10e-+14OH-=2CO32-+8H2O ①③⑤ (2a-b-1.5c) 1×1013 62.5% 可以充入适量的乙烯
【解析】(1)乙炔-空气燃料电池放电时,负极上乙炔失电子和氢氧根离子反应生成CO32-和水,正极上氧气得电子和水反应生成氢氧根离子,负极的电极反应式为:C2H2-10e-+14OH-=2CO32-+8H2O 答案为:C2H2-10e-+14OH-=2CO32-+8H2O
(2)①由图像可知,250℃时催化剂的催化效率最大,故①正确;②升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,乙烯的产率减小,故②不正确;③升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M点化学平衡常数大于点N点,故③正确;④N点的温度高,但催化剂的催化效率低;M点的催化剂的催化效率高,但温度低,所以N点正反应速率不一定大于M点正反应速率,故④不正确;⑤增大压强化学平衡向气体体积减小的方向移动,即向正方向移动,所以增大压强可提高乙烯的体积分数,故⑤正确;故答案为:①③⑤
(3)已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1= akJmol1.
②C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2=bkJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=ckJ/mol,
将①×2②③×![]() 可得:2CH4(g)
可得:2CH4(g)![]() C2H2(g)+3H2(g)△H=(2a-b-1.5c)kJ·mol-1
C2H2(g)+3H2(g)△H=(2a-b-1.5c)kJ·mol-1
答案为:(2a-b-1.5c)kJ·mol-1
(4)①1725℃时,设有n1mol CH4转化为C2H2,根据方程式2CH4(g)![]() C2H2(g)+3H2(g)可得:n(C2H2)= 0.5n1 mol;设有n2mol CH4转化为C2H4,根据方程式2CH4(g)
C2H2(g)+3H2(g)可得:n(C2H2)= 0.5n1 mol;设有n2mol CH4转化为C2H4,根据方程式2CH4(g)![]() C2H4(g)+2H2(g)可得n(C2H4)=0.5n2 mol。已知1725℃时,c(C2H2)=c(CH4),所以可得①0.5n1=0.3- n1- n2;由图像可知P(C2H4)=
C2H4(g)+2H2(g)可得n(C2H4)=0.5n2 mol。已知1725℃时,c(C2H2)=c(CH4),所以可得①0.5n1=0.3- n1- n2;由图像可知P(C2H4)=![]() Pa 、 P(C2H2)=
Pa 、 P(C2H2)=![]() Pa,由压强之比等于物质的量之比可得:②n(C2H2)/ n(C2H4)=
Pa,由压强之比等于物质的量之比可得:②n(C2H2)/ n(C2H4)=![]() P/
P/![]() Pa=10,由①和②联立可解得n1=
Pa=10,由①和②联立可解得n1=![]() n2=
n2=![]() mol。所以CH4的转化率=
mol。所以CH4的转化率=![]() ,答案为:62.5%
,答案为:62.5%
②1725℃时,由图像可知:P(CH4)=![]() Pa、P(C2H2)=
Pa、P(C2H2)=![]() Pa、P(H2)=
Pa、P(H2)=![]() Pa,Kp=
Pa,Kp=![]() =
=![]() = 1×1013.答案为:1×1013
= 1×1013.答案为:1×1013
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,答案为:可以充入适量的乙烯。

【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 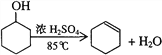
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
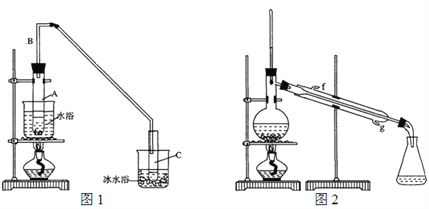
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点