题目内容
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
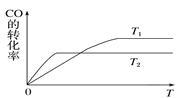
①T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为____ 。

②若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________。

【答案】> 12 b 270 4 K1=K2<K3
【解析】
(1)①根据图象,T2温度下,先达到平衡,说明T2>T1,温度越高,CO的转化率降低,说明正反应方向是放热反应,化学平衡常数只受温度的影响,升高温度,平衡逆反应进行,因此K1>K2;CO(g)+2H2(g)CH3OH(g)
起始: 1 2 0
消耗: 0.75 1.5 0.75
平衡: 0.25 0.5 0.75 根据化学平衡常数的定义,K=c(CH3OH)/[c2(H2)×c(CO)],代入数值,得出K=12;
②a、该反应正反应为放热反应,升高温度,平衡逆向进行,CO的转化率降低,故a不符合题意;
b、从体系中分离CH3OH,降低生成物的浓度,平衡向正反应方向进行,CO的转化率升高,故b符合题意;
c、使用催化剂,平衡不移动,CO转化率不变,故c不符合题意;
d、恒容状态下,充入非反应气体,组分浓度不变,平衡不移动,CO的转化率不变,故d不符合题意,答案为b;
(2)该反应为放热反应,相同起始组成比时,温度越高,平衡向逆反应方向进行,CO的转化率降低,故z曲线代表的是270℃;CO(g)+2H2(g)CH3OH(g)
起始: 1 1.5 0
消耗: 0.5 1 0.5
平衡: 0.5 0.5 0.5 根据化学平衡常数的定义,K=c(CH3OH)/[c2(H2)×c(CO)],代入数值,得出K=4;化学平衡常数只受温度的影响,即K1=K2,x的温度比z的温度低,即K3>K1=K2。