题目内容
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
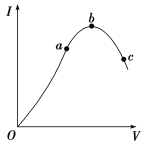
(1)“O”点导电能力为0的理由是_________________________。
(2)写出醋酸的电离方程式___________________________________________。
(3)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(4)a、b、c三点处,电离程度最大的是________。
(5)醋酸与氨水反应的离子方程式:__________________ 。
(6)写出醋酸电离平衡常数表达式:_______________;
(7)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(CH3COOH)_______(填“增大”、“减小”或“不变”);
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
【答案】纯醋酸未电离没有自由移动的离子,故不导电 CH3COOH![]() CH3COO-+H+ c<a<b c CH3COOH+NH3·H2O=CH3COO-+NH4++H2O K=
CH3COO-+H+ c<a<b c CH3COOH+NH3·H2O=CH3COO-+NH4++H2O K=![]() 右 减小 增大 < = =
右 减小 增大 < = =
【解析】
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:纯醋酸未电离没有自由移动的离子,故不导电;
(2)醋酸为弱电解质,其电离是不完全电离,其电离方程式为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
(3)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度关系为c<a<b;
(4)溶液越稀,越促进醋酸电离,则溶液稀释的倍数越大,电离程度越大,所以电离程度最大的是c,故答案为:c;
(5)醋酸为一元弱酸,氨水为一元弱碱,生成物水为弱电解质,离子方程式中均不拆分,生成的醋酸铵为盐,属于强电解质,需拆分,其反应的离子方程式为:CH3COOH+NH3·H2O=CH3COO-+NH4++H2O;
(6)根据电离平衡常数定义书写出其表达式为:K=![]() ;
;
(7)加水稀释,醋酸溶液浓度降低,根据越稀越电离,其电离平衡向右移动;平衡向右移动,导致n(CH3COOH)减小;![]() 等同于
等同于![]() ,根据上述分析,该比值增大;
,根据上述分析,该比值增大;
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液中溶质的物质的量相等,且二者均为一元酸,故二者所含总氢离子数相等,因醋酸为弱酸,盐酸为强酸,故a溶液中c(H+)<b溶液中c(H+),故与足量Zn分反应,初始速率a<b;生成H2的量a=b;完全中和这两种酸,消耗NaOH的量a=b。

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取9.0g A,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:_____。 |
(2)将此9.0g A在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______。 |
(3)另取9.0g A,跟足量的碳酸氢钠粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
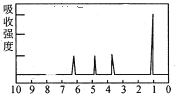
(4)A的核磁共振氢谱如图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式__________。 | |