题目内容
有关接触法制硫酸的叙述不正确的是( )。
| A.硫磺和硫铁矿均可作为生产原料 |
| B.将矿石粉碎,是为了提高矿石的利用率 |
| C.反应中通入过量的空气是为了提高FeS2和SO2的转化率 |
| D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸 |
D
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关工业生产的叙述正确的是
| A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C.电解精炼铜时,精铜作阴极 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
下列化学工业中,未涉及原料循环使用的是
| A.侯德榜制碱法 | B.索尔维制碱法 |
| C.工业电解饱和食盐水 | D.工业炼铁 |
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。 关于工业生产的叙述,错误的是 ( )。
| A.制普通玻璃的主要原料是纯碱、石灰石、石英 |
| B.氨是制作氮肥、硝酸、铵盐的重要原料 |
| C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 |
| D.制造普通水泥的主要原料是黏土、石灰石 |
认识反应条件对化学反应的影响,对学好化工生产知识具有重要意义。下列说法不正确的是 ( )。
| A.SO2合成SO3虽然属于放热反应,但工业上合成SO3时仍需加热 |
| B.合成氨工业采用高温高压和使用催化剂,因这些条件都符合化学平衡原理 |
| C.合成纯碱的过程中,应首先向饱和食盐水中通入NH3,再通入足量CO2 |
| D.通过加压降温的方法可获得制备NH3的原料气N2 |
某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下:
下列推断不合理的是 ( )。
| A.往甲中通CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.在实际生产中CO2可被循环使用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
要经常向农田里施用钾肥的主要原因是( )。
| A.土壤中钾元素的含量太少,需靠施用钾肥才能满足农作物生长的需要 |
| B.土壤中钾元素的含量不少,但大多数以难溶于水的矿物质形式存在,农作物难以吸收 |
| C.土壤中钾元素的含量不少,但都易溶于水被雨淋失,需施钾肥加以补充 |
| D.钾元素是农作物生长需要量最大的元素,必须经常施钾肥加以补充 |

 SrSO4(s)+CO
SrSO4(s)+CO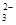 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO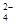 (aq)
(aq)