题目内容
要经常向农田里施用钾肥的主要原因是( )。
| A.土壤中钾元素的含量太少,需靠施用钾肥才能满足农作物生长的需要 |
| B.土壤中钾元素的含量不少,但大多数以难溶于水的矿物质形式存在,农作物难以吸收 |
| C.土壤中钾元素的含量不少,但都易溶于水被雨淋失,需施钾肥加以补充 |
| D.钾元素是农作物生长需要量最大的元素,必须经常施钾肥加以补充 |
B
解析

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。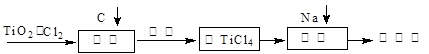
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)
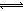 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)
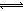 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 (4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
下列关于化工生产的叙述中,符合目前工业生产实际的是
| A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂 |
| C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是
| A.氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率 |
下列关于工业生产的说法中,错误的是( )。
| A.氯碱工业中的阳离子交换膜阻止阳离子通过 |
| B.生产普通玻璃的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 |
| D.工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅 |
用硫铁矿做原料,用接触法生产硫酸的过程中,对废弃资源的处理不正确的是 ( )。
| A.氨—酸法尾气脱硫是先将尾气用氨水吸收,然后再用浓硫酸处理 |
| B.与尾气脱硫技术相比,两转两吸流程投资较少,但运行费用相对较高 |
| C.可以从制硫酸排出的烧渣中回收铁、有色金属以及贵重金属金和银 |
| D.沸腾炉旁可以设置“废热”锅炉,利用余热产生的蒸汽来发电或供热 |
有关接触法制硫酸的叙述不正确的是( )。
| A.硫磺和硫铁矿均可作为生产原料 |
| B.将矿石粉碎,是为了提高矿石的利用率 |
| C.反应中通入过量的空气是为了提高FeS2和SO2的转化率 |
| D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸 |
下列关于化工生产原理的几种叙述中,均符合目前工业生产实际情况的是( )
| A.石油是烃的混合物,石油工业中采用干馏的方法把石油分成不同沸点范围的产物 |
| B.氯气和氢气混合在光照条件下生成氯化氢,再用水吸收生成盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体来说氨的产率很高 |
 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为 (用含a的代数式表示)。