题目内容
【题目】铜是人类最早使用的金属之一。
(1)铜元素基态原子的价电子排布式为_______,其核外能级能量的高低3d______4s(填“>”、“<”或“=”)
(2)Cu与元素A能形成如下图所示的两种化合物甲和乙。元素A是短周期非金属元素,A的常见氧化物常温下为液态,其熔沸点比同主族其他元素的氧化物高。
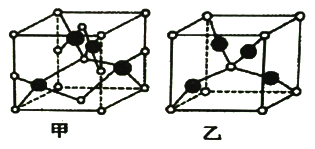
① 两种化合物的化学式分别为:甲___________,乙___________。
② 热稳定性甲_________乙(填“>”、“<”或“=”),试从原子结构上解释原因____。
(3)铜离子形成的某种配合物阳离子具有轴向狭长的八面体结构(如下图)。
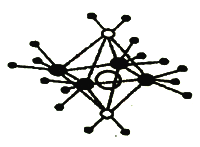
已知两种配体都是10电子的中性分子,且都含氢元素。
① 两种配体分子的配位原子电负性大小为______(填元素符号),其中热稳定性较弱的配体为(用电子式表示)__________。
② 该配合物阳离子与SO42-形成的配合物X的化学式为_________.
(4)Cu单质的晶体为面心立方堆积,其晶胞立方体的边长为acm, Cu的相对原子质量为63.5,单质Cu的密度为ρg/cm3,则阿伏加德罗常数可表示为_____mol-1(含“a、ρ的代数式表示)。
【答案】 3d104s1 > CuO Cu2O < Cu2O中Cu的d轨道为全充满状态,较稳定 O>N 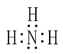 [Cu(H2O)2(NH3)4]SO4 254/(ρa3)
[Cu(H2O)2(NH3)4]SO4 254/(ρa3)
【解析】(1)铜原子核电荷数为29,其基态原子的电子排布式为[Ar]3d104s1 ,则价电子排布式为3d104s1 ,根据能级图可知其核外能级能量的高低3d>4s;
(2)元素A是短周期非金属元素,A的常见氧化物常温下为液态,其熔沸点比同主族其他元素的氧化物高,可知A为氧元素;
① 甲中氧原子数目为8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,Cu原子数为4,则甲的化学式为CuO;乙中氧原子数目为8×
+1=4,Cu原子数为4,则甲的化学式为CuO;乙中氧原子数目为8×![]() +1=2,Cu原子数为4,则乙的化学式为Cu2O;
+1=2,Cu原子数为4,则乙的化学式为Cu2O;
② 因 Cu2O中Cu+的电子排布式为[Ar]3d10,而CuO中Cu2+的电子排布式为[Ar][Ar]3d9,明显Cu+的d轨道为全充满状态,较稳定,故稳定性CuO<Cu2O;
(3)两种配体都是10电子的中性分子,且都含氢元素,可知两配体分别为H2O和NH3;
① 两种配体分子中N和O均有孤对电子,可与中心原子间形成配位键,O的非金属性比N强,即电负性O>N,且NH3的稳定性小于H2O,NH3的电子式为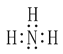 ;
;
② 由该配合物阳离子的结构可知含有4个NH3和2个H2O,则与SO42-形成的配合物X的化学式为 [Cu(H2O)2(NH3)4]SO4 ;
(4)由晶胞结构示意图可知,晶体的堆积模型为面心立方密堆积,晶胞中原子数目为6×![]() +8×
+8×![]() =4,晶胞质量为4×63.5g÷NA,晶胞体积为(a cm)3,则4×63.5g÷NA=ρg/cm3×(a cm)3,故NA=254/(ρa3)mol-1。
=4,晶胞质量为4×63.5g÷NA,晶胞体积为(a cm)3,则4×63.5g÷NA=ρg/cm3×(a cm)3,故NA=254/(ρa3)mol-1。

 全程金卷系列答案
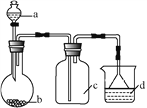
全程金卷系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 |
中的物质 |
中的物质 |
收集的气体 |
|
| 浓氨水 |
|
|
|
| 浓硫酸 |
|
|
|
| 稀硝酸 |
|
|
|
| 稀盐酸 |
|
|
|
A. A B. B C. C D. D