题目内容
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
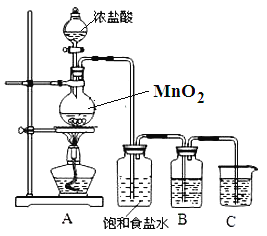
(1)装置B中盛放的试剂是_____(填选项),实验现象为_____,化学反应方程式是_____.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是_____.
(3)能证明氯元素比硫元素非金属性强的依据为_____. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2﹣比Cl﹣还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象_____,写出反应的离子方程式_____.
【答案】 A 产生淡黄色沉淀 Na2S+Cl2=2NaCl+S↓ 吸收氯气,防止污染大气 ①③④ 下层为紫色 2I﹣+Cl2=2Cl﹣+I2
【解析】试题分析:(1)从置换反应判断元素非金属性强弱分析,氯气能把硫元素从其硫化钠溶液中置换出来;
(2)氯气为有毒气体,要进行尾气处理;
(3)利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱,以此来解答;
(4)氯气与碘化钾反应生成单质碘.
解:(1)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2﹣═2Cl﹣+S↓;反应中有淡黄色沉淀生产;
故答案为:A;产生淡黄色沉淀;Na2S+Cl2=2NaCl+S↓;
(2)氯气为有毒气体,要进行尾气处理,氯气能与氢氧化钠溶液反应,所以装置C中盛放烧碱溶液的作用是吸收氯气,防止污染大气;
故答案为:吸收氯气,防止污染大气;
(3)能证明氯元素比硫元素非金属性强的依据①氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强,故正确,②通过最高价含氧酸的酸性可以比较非金属性,不能比较其氧化性,故错误③S2﹣比Cl﹣还原性强,根据阴离子的还原性越弱非金属性越强来判断,故正确④氢化物越稳定,非金属性越强,故正确,所以①③④,
故答案为:①③④;
(4)氯气与碘化钾反应生成单质碘,加CCl4试剂,溶液会分层,下层为碘单质和CCl4,所以下层呈紫色,其反应的离子方程式为:2I﹣+Cl2=2Cl﹣+I2,
故答案为:下层为紫色;2I﹣+Cl2=2Cl﹣+I2.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案