题目内容
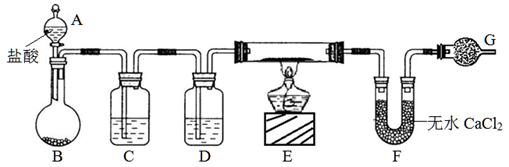
(10分)实验室有CuO和铜粉的混合物。要测定该样品(已称得其质量为m g)中氧化铜的质量分数。用下图所示仪器装置制取H2,再用H2还原CuO,最后根据样品质量的减少和无水CaCl2质量的增加来测定样品中氧化铜的质量分数。
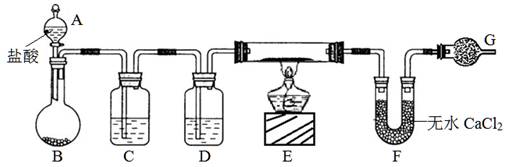
请回答:
(1)仪器中装入的试剂:D 。
(2)操作“①打开A的活塞”和“②点燃E处酒精灯”应该先进行的是 (填序号),在这两步操作之间还应进行的操作是: 。
(3)若实验中有部分CuO被还原为红色的Cu2O,对实验的影响为_____(偏大、偏小、无影响)。
(4)若测得的原质量为a g的硬质玻璃管(E),反应后质量变为b g;U型管实验后质量增加n g,由以上数据可以列出计算氧化铜质量分数的两个不同计算式:
计算式1: ;计算式2: 。
(1)浓硫酸(1分)
(2)①(1分)收集G处的气体检验纯度(2分)
(3)偏小(2分)
(4)5(a-b)/m(2分) 40n/9m(2分)
【解析】(1)由于生成的氢气中含有水蒸气,会干扰后面的实验,所以D中的盛放的应该是浓硫酸,用来除去水蒸气。
(2)由于装置中含有空气,所以应该首先生成氢气,将装置中的空气排尽。氢气是可燃性气体,再点燃之前,需要收集G处的气体检验纯度。
(3)若实验中有部分CuO被还原为红色的Cu2O,则生成的水就减少,因此氧化铜的质量分数就减少。
(4)根据方程式H2+CuO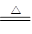 Cu+H2O可知,固体减少的质量就是氧化铜中氧原子的质量,所以氧化铜的质量是
Cu+H2O可知,固体减少的质量就是氧化铜中氧原子的质量,所以氧化铜的质量是 ,所以氧化铜的质量分数是5(a-b)/m;生成水的质量是ng,则氧化铜的质量是
,所以氧化铜的质量分数是5(a-b)/m;生成水的质量是ng,则氧化铜的质量是 ,所以氧化铜的质量分数是40n/9m。
,所以氧化铜的质量分数是40n/9m。

 每课必练系列答案
每课必练系列答案实验方法 | 实验过程中反应的化学方程式 | 实验所选用仪器的编号 | 实验需直接测定的有关物理量(用文字说明) |
1 |
|
|
|
2 |
|
|
|
实验可能用到的主要仪器:①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯⑥坩埚 ⑦酒精灯 ⑧玻璃棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
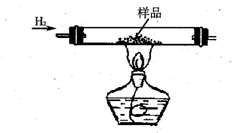 实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.
实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.