题目内容
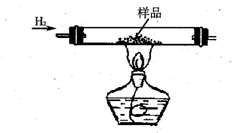 实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.
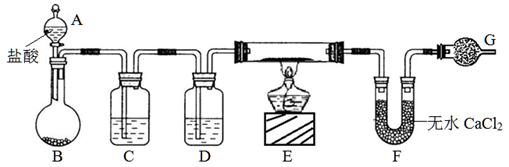
实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.(一)甲同学用“盐酸与锌反应生成的氢气还原氧化铜,再称取所得铜的总质量”的实验方法进行测定.部分实验装置如下:
请回答:
(1)对硬质玻璃管加热前如何检验空气是否已经排尽
(2)在制氢气装置与硬质玻璃管之间是否需要连接除杂装置?
理由是
(3)若m g样品经充分反应至固体质量不再减轻为止后,冷却、称量所得固体物质的质量为n g.则样品中氧化铜的质量分数为
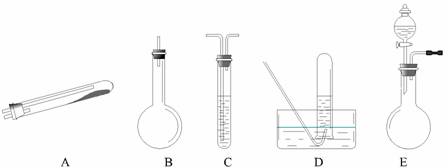
(二)乙同学利用下列实验仪器及试剂,设计出两种方法测定样品中氧化铜的质量分数.
请你填写表格中的有关内容.
实验可能用到的主要仪器:①托盘天平、②玻璃棒、③漏斗、④泥三角、⑤烧杯、⑥坩埚、⑦酒精灯、⑧三角架
实验可能用到的试剂:a.稀硝酸b.稀硫酸c.蒸馏水d.浓硫酸
| 实验方法 | 有关化学方程式 | 实验用仪器(填序号) | 实验需直接测定的物理量(用文字说明) |
| (1) | H2SO4+CuO═CuSO4+H2O | ||
| (2) | 实验前坩埚与样品总质量(或坩埚质量)、实验后坩埚与CuO总质量 |
分析:(一)(1)检验进入该装置的氢气的纯度可以检验装置中的空气是否排净;
(2)金属锌和盐酸反应生成的氢气中混有氯化氢杂质;
(3)根据固体质量差量法计算;
(二)CuO和铜粉的混合物中,测定该样品(已称得其质量为m g)中氧化铜的质量分数的方法:①金属铜和非氧化性的酸反应,但是氧化铜能和酸反应,据此获得混合物中金属铜的质量即可;②金属铜在氧气中加热可以生成氧化铜,可以根据固体质量的增加来计算金属铜的质量进而计算氧化铜的质量分数.
(2)金属锌和盐酸反应生成的氢气中混有氯化氢杂质;
(3)根据固体质量差量法计算;
(二)CuO和铜粉的混合物中,测定该样品(已称得其质量为m g)中氧化铜的质量分数的方法:①金属铜和非氧化性的酸反应,但是氧化铜能和酸反应,据此获得混合物中金属铜的质量即可;②金属铜在氧气中加热可以生成氧化铜,可以根据固体质量的增加来计算金属铜的质量进而计算氧化铜的质量分数.
解答:解:(一)(1)检验空气已经排尽的方法为检验通过硬玻璃管的氢气纯度,装置出来的氢气纯则说明空气已排净,
故答案为:检验通过硬玻璃管的氢气纯度,装置出来的氢气纯则说明空气已排净;
(2)金属锌和盐酸反应生成的氢气中混有氯化氢杂质,氯化氢可以与氧化铜反应,会影响实验,所以需要除杂,故答案为:需要,因盐酸易挥发,与氧化铜反应影响实验;
(3)若mg样品经充分反应至固体质量不再减轻为止后,冷却、称量所得固体物质的质量为ng,固体质量减少了(m-n)g,设氧化铜质量是x,
H2+CuO
Cu+H2O 固体质量减少量
80 16
x m-n
=
,解得x=5(m-n),所以氧化铜的质量分数=
,故答案为:
;
(二)CuO和铜粉的混合物中,测定该样品(已称得其质量为m g)中氧化铜的质量分数的方法:①金属铜和非氧化性的酸如盐酸反应,但是氧化铜能和盐酸反应,根据反应后过滤得到的固体即为金属铜,称量出金属铜的质量可以获得氧化铜的质量以及质量分数,该过程用到的仪器是:托盘天平、玻璃棒、漏斗、烧杯;
②金属铜在氧气中加热可以生成氧化铜,固体质量会增大,可以根据固体质量的变化来计算金属铜的质量,进而计算氧化铜的质量分数,需要称取反应之前固体质量以及反应后的固体质量,故答案为:
故答案为:检验通过硬玻璃管的氢气纯度,装置出来的氢气纯则说明空气已排净;
(2)金属锌和盐酸反应生成的氢气中混有氯化氢杂质,氯化氢可以与氧化铜反应,会影响实验,所以需要除杂,故答案为:需要,因盐酸易挥发,与氧化铜反应影响实验;
(3)若mg样品经充分反应至固体质量不再减轻为止后,冷却、称量所得固体物质的质量为ng,固体质量减少了(m-n)g,设氧化铜质量是x,
H2+CuO
| ||
80 16
x m-n
| 80 |
| x |
| 16 |
| m-n |
| 5(m-n) |
| m |
| 5(m-n) |
| m |
(二)CuO和铜粉的混合物中,测定该样品(已称得其质量为m g)中氧化铜的质量分数的方法:①金属铜和非氧化性的酸如盐酸反应,但是氧化铜能和盐酸反应,根据反应后过滤得到的固体即为金属铜,称量出金属铜的质量可以获得氧化铜的质量以及质量分数,该过程用到的仪器是:托盘天平、玻璃棒、漏斗、烧杯;
②金属铜在氧气中加热可以生成氧化铜,固体质量会增大,可以根据固体质量的变化来计算金属铜的质量,进而计算氧化铜的质量分数,需要称取反应之前固体质量以及反应后的固体质量,故答案为:
| 方法(1) | ①②③⑤ | 过滤后剩余固体的质量 | |||||
| 方法(2) | 2Cu+O2
|
①②④⑥⑦⑧ |
点评:本题是一道物质的组成和含量测定的综合实验考查题,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
相关题目
实验室有CuO和铜粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m g)中氧化铜质量分数的方法,并填写表格中的有关内容。
实验方法 | 实验过程中反应的化学方程式 | 实验所选用仪器的编号 | 实验需直接测定的有关物理量(用文字说明) |
1 |
|
|
|
2 |
|
|
|
实验可能用到的主要仪器:①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯⑥坩埚 ⑦酒精灯 ⑧玻璃棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸