��Ŀ����
����Ŀ������ǰ 4 �����е� A��B��C��D��E ��������Ԫ�أ�A ����������ﺬ A �� ������ 40%��A ԭ����������������������B ��ͬ�����г�ϡ��������ԭ�Ӱ뾶����Ԫ �أ�D ���γ� BD �����ӻ������ B��D �����ӵĵ��Ӳ�ṹ��ͬ��C �� D ���γ� CD3 �Ļ����C ԭ�ӱ� E ԭ�Ӷ� 1 �����ӣ�B��C��D ������������ˮ�����������ɷ�Ӧ �����κ�ˮ��D ԭ�ӱ� A ԭ�Ӷ� 1 �����ӣ���
��1��B ԭ�ӽṹʾ��ͼΪ
��2���õ���ʽ��ʾ A �� B ��ɵĻ�������γɹ���
��3�������ӷ���ʽ��ʾ A �� D �ķǽ�����ǿ��
��4��д�� C ������������ˮ����ֱ�� B��D ������������ˮ���ﷴӦ�����ӷ� ��ʽ
��5��DE �γɵĻ������л�ѧ������Ϊ
��6��A2D2������ÿһ��ԭ�Ӿ��ﵽ����� 8e���ȶ��ṹ����д�������ʽ�ͽṹʽ�� ��
���𰸡�
��1��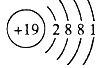
��2��![]()
��3��Cl2+S2��=2Cl��+S��
��4��Al��OH��3+3H+=Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O
��5�����Ӽ�
��6��![]() ��
��![]()
���������⣺ǰ4�����е�A��B��C��D��E��������Ԫ�أ�A����������ﺬA40%��Aԭ����������������������A����������A����Ԫ�ص�������Ϊ2��3��SO3��SԪ�غ���Ϊ40%������A��SԪ�أ�Dԭ�ӱ�Aԭ�Ӷ�1�����ӣ���D��ClԪ�أ�B��ͬ�����г�ϡ��������ԭ�Ӱ뾶����Ԫ�أ���Bλ�ڵ�IA��Ԫ�أ�D���γ�BD�����ӻ������B��D�����ӵĵ��Ӳ�ṹ��ͬ��B�ǵ�IA��Ԫ�أ���D�ǵ�VIIA��Ԫ�أ�BԪ��λ��DԪ����һ���ڣ���B��KԪ�أ�C��D���γ�CD3�Ļ������Cλ�ڵ�IIIA�壬��֪CΪAlԪ�أ�Cԭ�ӱ�Eԭ�Ӷ�1�����ӣ���E��MgԪ�أ���1����ԭ�Ӻ˵����Ϊ19����ԭ�ӽṹʾ��ͼΪ  �����Դ��ǣ�
�����Դ��ǣ� 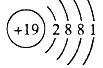 ����2��K��S������ӻ�����K2S�������ʽ�γɹ���Ϊ
����2��K��S������ӻ�����K2S�������ʽ�γɹ���Ϊ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����3���Ƚ�Ԫ�صķǽ�����ǿ������ͨ��������ԭ��Ӧ�Ƚϵ��ʵ�������ǿ���������ͨ����������Һ��ͨ�����������ɣ��ó��ȵķǽ����Ա�ǿ�Ľ��ۣ�������Ӧ�����ӷ���ʽΪCl2+S2��=2Cl��+S�������Դ��ǣ�Cl2+S2��=2Cl��+S������4��Al������������ˮ����ΪAl��OH��3 �� ��������������ܺ�ǿ�ᡢǿ�Ӧ���ֱ��ܽ���HClO4��KOH ������������ˮ���ﷴӦ�����ӷ���ʽΪ��Al��OH��3+3H+=Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+3H+=Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O����5��þԪ�غ���Ԫ���γɵĻ�����MgCl2 �� �����ӻ�������еĻ�ѧ��Ϊ���Ӽ����Դ��ǣ����Ӽ�����6��S2Cl2�ǹ��ۻ����������ÿһ��ԭ�Ӿ��ﵽ����� 8e���ȶ��ṹ����֪������֮��ֻ���γ�һ�����õ��Ӷԣ���������֮��Ҳ�γ�һ�����õ��Ӷԣ������ʽ�ͽṹʽ�ֱ�Ϊ
����3���Ƚ�Ԫ�صķǽ�����ǿ������ͨ��������ԭ��Ӧ�Ƚϵ��ʵ�������ǿ���������ͨ����������Һ��ͨ�����������ɣ��ó��ȵķǽ����Ա�ǿ�Ľ��ۣ�������Ӧ�����ӷ���ʽΪCl2+S2��=2Cl��+S�������Դ��ǣ�Cl2+S2��=2Cl��+S������4��Al������������ˮ����ΪAl��OH��3 �� ��������������ܺ�ǿ�ᡢǿ�Ӧ���ֱ��ܽ���HClO4��KOH ������������ˮ���ﷴӦ�����ӷ���ʽΪ��Al��OH��3+3H+=Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O�����Դ��ǣ�Al��OH��3+3H+=Al3++3H2O��Al��OH��3+OH��=AlO2��+2H2O����5��þԪ�غ���Ԫ���γɵĻ�����MgCl2 �� �����ӻ�������еĻ�ѧ��Ϊ���Ӽ����Դ��ǣ����Ӽ�����6��S2Cl2�ǹ��ۻ����������ÿһ��ԭ�Ӿ��ﵽ����� 8e���ȶ��ṹ����֪������֮��ֻ���γ�һ�����õ��Ӷԣ���������֮��Ҳ�γ�һ�����õ��Ӷԣ������ʽ�ͽṹʽ�ֱ�Ϊ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ��
��