题目内容
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+ 1/2 O2(g)  CO2(g) ?H=-283.0 kJ/mol
CO2(g) ?H=-283.0 kJ/mol
S(g)+ O2(g) SO2(g) ?H=-296.0 kJ/mol
SO2(g) ?H=-296.0 kJ/mol
下列说法不正确的是:
| A.两个反应均为氧化还原反应 |
| B.CO2与SO2可以用澄清石灰水鉴别 |
| C.CO2分子中各原子最外层均为8电子稳定结构 |
D.相同条件下:2CO(g)+SO2(g)  S(g)+2CO2 (g)?H=-270kJ/mol S(g)+2CO2 (g)?H=-270kJ/mol |
B
解析试题分析:两个反应中都有单质参加反应,元素化合价一定发生变化,属于氧化还原反应,故A正确;CO2与SO2都可以与澄清石灰水反应生成沉淀,不能用石灰水鉴别,可用溴水或酸性高锰酸钾溶液鉴别,故B错误;二氧化碳的结构式为O=C=O,C原子最外层电子数为4,O原子最外层电子数为6,化合物中C元素化合价为+4价,O元素化合价为-2价,由此可知各原子最外层均为8电子稳定结构,故C正确;已知:①CO(g)+1 2 O2(g)═CO2(g)△H=-283.0kJ·mol-1,②S(g)+O2(g)═SO2(g)△H=-296.0kJ·mol-1,利用盖斯定律将①×2-②可得2CO(g)+SO2(g)═S(g)+2CO2(g)△H=(-283.0kJ·mol-1)×2-(-296.0kJ·mol-1)=-270kJ·mol-1,故D正确,故选B。
考点:考查氧化还原反应、物质的鉴别、原子核外电子集排布以及盖斯定律的应用。

欲迅速除去铝壶底的水垢,最好的试剂是
| A.浓盐酸 | B.稀硝酸 | C.浓硫酸 | D.浓硝酸 |
50g含有1.17g氯化钠和0.84g氟化钠的溶液中加入过量的硝酸银溶液,充分反应搅拌、静止、过滤、洗涤、干燥得到2.87g固体,由此得出的结论是
| A.氯离子只有一部分参加反应 |
| B.氟离子只有一部分参加反应 |
| C.氟化银难溶于水 |
| D.氟化钠和硝酸银在溶液中无沉淀生成 |
下列叙述正确的是
| A.由NH3制碳铵和硫铵是“固氮”过程 |
| B.浓硝酸虽然是氧化性酸,但是不能氧化单质银 |
| C.SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 |
| D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全 |
设空气中O2的体积分数为0.2,N2的体积分数为0.8。在有水存在的条件下,某氮的氧化物(NO与NO2形成的混合物)和一定量空气混合恰好完全反应生成硝酸,反应后气体体积减少了一半(相同条件下)。则该氮的氧化物中NO与NO2的体积比可能是
| A.1∶5 | B.1∶4 |
| C.1∶3 | D.任意比 |
2012年3月13日,一艘运载7 000吨浓硫酸的韩国籍货船在汕尾海域发生自沉,船上18名外籍船员被救起。下列有关说法正确的是( )。
| A.浓硫酸易挥发,从沉船中抽出的浓硫酸要密封保存 |
| B.抽出的浓硫酸有很强的氧化性,不能直接保存在铁制容器中 |
| C.在打捞时,如果盛装浓硫酸的舱室内进水,可能会发生爆炸 |
| D.硫酸工业尾气虽然无害,但它的过度排放会造成温室效应 |
下列叙述正确的是( )
| A.含1 mol H2SO4的浓硫酸中有n(H+)=2n(SO42-)=2 mol |
| B.含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子为2 mol |
| C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) |
| D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1 |
一定温度下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH变化的曲线如图所示。下列叙述中正确的是( )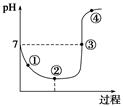
| A.①点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| B.②点的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) |
| C.③点的溶液中:c(Na+)=2c(ClO-)+c(HClO) |
| D.④点的溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
下列关于无机非金属材料的说法中正确的是 ( )。
| A.传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料 |
| B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差 |
| C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点 |
| D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 |