题目内容
【题目】在湿法炼锌的电解循环溶液中,含较高浓度的![]() ,可向溶液中同时加入Cu和
,可向溶液中同时加入Cu和 ![]() ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去![]() ,反应原理如下:
,反应原理如下:![]() ;
;![]() ;室温时,实验测得电解液pH对溶液中残留
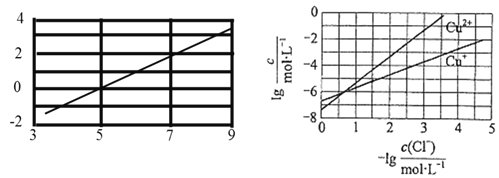
;室温时,实验测得电解液pH对溶液中残留![]() 的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
的影响和平衡时溶液中相关离子浓度的关系如图所示下列说法正确的是( )
A.已知室温时AgCl的溶度积常数约为![]() ,则:
,则:![]()
B.向电解液中加入稀硫酸,有利于![]() 的除去
的除去
C.![]() 的平衡常数的数量级是
的平衡常数的数量级是![]()
D.除去上述电解循环溶液的产生![]() 的
的![]()
![]()
【答案】A
【解析】
A. 根据图示,当氯离子浓度的负对数为3.5时,即c(Cl-)=10-3.5mol/L,则c(Cu+)=10-3mol/L,![]() =c(Cl-) c(Cu+)=10-3.5mol/L×10-3mol/L=10-6.5,则
=c(Cl-) c(Cu+)=10-3.5mol/L×10-3mol/L=10-6.5,则![]() ,故A正确;
,故A正确;
B. 根据图中信息:溶液的pH越大,氯离子的浓度越小,电解液中加入稀硫酸,不利于![]() 的去除,故B错误;
的去除,故B错误;
C. 反应![]() ,其平衡常数为
,其平衡常数为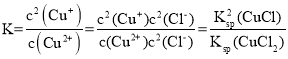 ,根据图二,当氯离子浓度负对数为0.5时,
,根据图二,当氯离子浓度负对数为0.5时,![]() =
=![]() =10-6mol/L,Ksp(CuCl2)=c(Cu2+)c2(Cl-)=10-7,代入数据得K=
=10-6mol/L,Ksp(CuCl2)=c(Cu2+)c2(Cl-)=10-7,代入数据得K=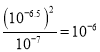 ,平衡常数的数量级是
,平衡常数的数量级是![]() ,故C错误;
,故C错误;
D. ![]() ,
,![]() ;
;
![]()
![]() ,
,![]() 可得到:
可得到:![]() ,根据盖斯定律反应的
,根据盖斯定律反应的![]()
![]() ,故D错误;
,故D错误;
答案选A。

【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);