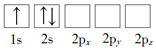
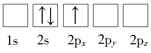
题目内容
【题目】将1mol固体A置于体积不变的真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其分解:A(s)![]() 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是( )
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是( )
A.反应速率:vB(正)=vC(逆)
B.B的体积分数不变
C.气体的密度保持不变
D.混合气体的平均摩尔质量保持不变
【答案】C
【解析】
A.由方程式可知:vB(正)=2vC(正),当vB(正)=vC(逆)时,2vC(正)= vC(逆),vC(正) ≠vC(逆),反应没有达到平衡,A错误;
B.假设某时刻消耗A的物质的量为xmol,那么生成2xmolB,生成xmolC,B的体积分数=![]() =
=![]() ,所以,不管反应是否达到平衡,B的体积分数都不变,B错误;
,所以,不管反应是否达到平衡,B的体积分数都不变,B错误;
C.密闭恒容容器,若气体的密度保持不变,说明气体的质量不再改变,那么B和C的质量都不改变,说明反应达到平衡,C正确;
D.假设某时刻消耗A的物质的量为xmol,那么生成2xmolB,生成xmolC,则混合气体的平均摩尔质量=![]() ,由于B、C的摩尔质量是个常数,所以,不管反应是否达到平衡,混合气体的平均摩尔质量都不变,D错误。
,由于B、C的摩尔质量是个常数,所以,不管反应是否达到平衡,混合气体的平均摩尔质量都不变,D错误。
答案选C。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变