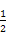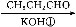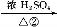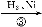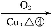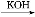题目内容
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
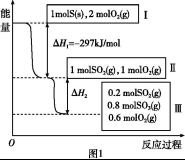
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
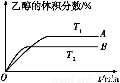
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.升温 B.加压
C.加催化剂D.增加CO2的浓度
(4)现有甲、乙两装置,甲装置为原电池,乙装置为电解池。
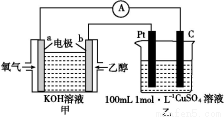
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
(1)C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(l) ΔH=-46a kJ·mol-1
2CO2(g)+3H2O(l) ΔH=-46a kJ·mol-1
(2)①< ②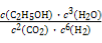 (3)BD
(3)BD
(4)①C2H5OH+16OH--12e- 2C
2C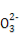 +11H2O
+11H2O
②17.92
【解析】(1)1 g乙醇燃烧放出a kJ热量,所以1 mol乙醇燃烧放出的热量为46a kJ。注意放热反应的ΔH<0。
(2)①T2时达到平衡所用时间短,说明温度高。但达到平衡时乙醇的体积分数小,说明升高温度平衡逆向移动,故ΔH<0。②根据平衡常数的定义即可写出平衡常数表达式。
(3)升温平衡逆向移动,H2的转化率减小,A错误;加压平衡正向移动,H2的转化率增大,B正确;催化剂不能使平衡移动,C错误;增加二氧化碳的浓度,平衡正向移动,H2的转化率增大,D正确。
(4)①该燃料电池的总反应为C2H5OH+3O2+4OH- 2C
2C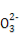 +5H2O,a极的电极反应式为O2+2H2O+4e-
+5H2O,a极的电极反应式为O2+2H2O+4e- 4OH-。用总反应式减去a极的电极反应式得b极的电极反应式为C2H5OH+16OH--12e-
4OH-。用总反应式减去a极的电极反应式得b极的电极反应式为C2H5OH+16OH--12e- 2C
2C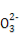 +11H2O。
+11H2O。
②若甲装置中有0.1 mol C2H5OH参加反应,则转移电子1.2 mol。乙装置中阳极的电极反应式为4OH--4e- 2H2O+O2↑,根据电子守恒可知该极生成0.3 mol O2。阴极先发生反应:2Cu2++4e-
2H2O+O2↑,根据电子守恒可知该极生成0.3 mol O2。阴极先发生反应:2Cu2++4e- 2Cu,因0.1 mol Cu2+消耗0.2 mol电子,故继续发生反应:2H++2e-
2Cu,因0.1 mol Cu2+消耗0.2 mol电子,故继续发生反应:2H++2e- H2↑,转移1.0 mol电子生成0.5 mol H2。共生成0.8 mol气体,标准状况下其体积为17.92 L。
H2↑,转移1.0 mol电子生成0.5 mol H2。共生成0.8 mol气体,标准状况下其体积为17.92 L。