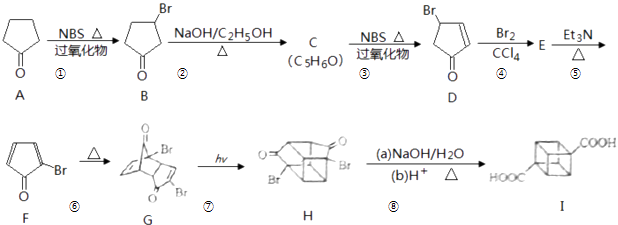
题目内容
【题目】按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:
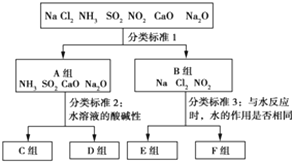
(1)上图中分类标准1(分成A、B组的依据)为_________________________________。
(2)工业上常用D组中________________(填化学式),来消除C组中物质对大气的污染,该反应的化学方程式为_____________________________________________。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,离子方程式为__________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途: ________________________________;________________________________________。
【答案】 是否与水发生氧化还原反应 CaO SO2+CaO===CaSO3、2CaSO3+O2===2CaSO4 NH3 Al3++3NH3·H2O===Al(OH)3↓+3NH![]() 2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O 3NO2+H2O===2HNO3+NO(其他合理答案均可)
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O 3NO2+H2O===2HNO3+NO(其他合理答案均可)
【解析】(1)溶于水分成AB两组的依据,分析反应过程可知,NH3、Na2O、SO2、CaO溶于水发生化合反应生成对应酸或碱,是非氧化还原反应;Cl2、Na、NO2,溶于水反应发生的是氧化还原反应,所以依据是是否与水发生氧化还原反应;(2)A组中的根据水溶液的酸碱性可以分为:溶液显酸性:SO2;溶液显碱性:NH3、CaO、Na2O;对空气有污染的是SO2,而通常选用CaO来消除SO2对空气的污染,反应为:SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4;(3)Al(OH)3易溶于强碱,不溶于氨水,故实验室由Al3+制备Al(OH)3时,应选用D组中的氨水,反应为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(4)钠与水的反应中,水做氧化剂;氯气、NO2与水的反应中,水既不做氧化剂也不做还原剂,故F组的物质为Cl2和NO2,Cl2的用途是制取漂白粉:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,二氧化氮溶于水制备硝酸:3NO2+H2O=2HNO3+NO。

 名校课堂系列答案
名校课堂系列答案【题目】环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):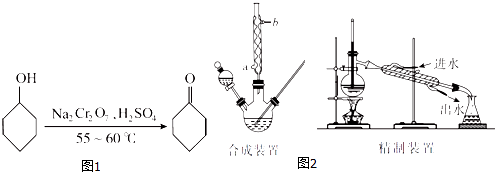
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3 , 20℃) | 溶解性 |
环己醇 | 100 | 161.1(97.8) | 0.9624 | 能溶于水 |
环己酮 | 98 | 155.6(95) | 0.9478 | 微溶于水 |
水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取(填“100 mL”或“250mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是的混合物.
(4)合成装置中冷凝管的作用是 , 冷凝水从冷凝管的(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是 .
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是 . (任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是 .