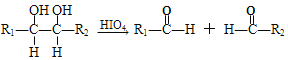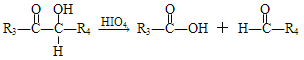题目内容
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
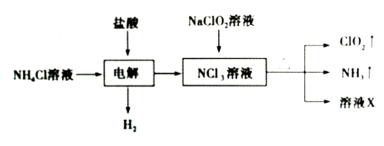
下列说法正确的是
A.电解时发生反应的离子方程式为:NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
【答案】B
【解析】
试题分析:A、题给离子方程式中电荷不守恒,错误;B、大量存在Cl-和OH-的原因在于溶液X前的反应物中存在氯元素,但生成物种无氯元素,反应物中没有氢元素,但后面产生了NH3,证明水中的氢参与反应,同时导致OH-会增多,正确;C、二氧化氯(ClO2)是一种黄绿色易溶于水的气体,食盐水不仅仅要除去NH3,而且也会除去ClO2,错误;D、根据题意知NaClO2 具有还原性,想要除去NaClO2 需要加入氧化剂,明矾中各元素的化合价不变,不能除去NaClO2,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目