题目内容
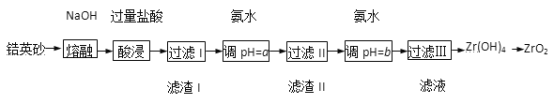
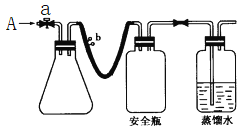
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,设计了如图的装置。试回答下列问题:
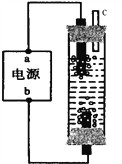
(1)电源中电极a的名称是__________。(正极、负极)
(2)氯气被吸收时所发生反应的化学方程式为_______________。
(3)检验Cl2是否吸收完全,可采用的方法是______________。
(4)研究表明,当NaCl刚好电解完时,溶液中只有一种溶质,则该溶质最有可能是________________。由此可以用一个化学方程表示该容器中所发生的化学反应,该化学方程式为_______________。
(5)NaCl中往往含有CaCl2、MgSO4杂质,为了除去上述杂质,可选用A:BaCl2、B:Na2CO3、C:NaOH、D:HCl。
使用试剂正确的顺序为(________________________)。
【答案】 负极 2NaOH + Cl2 == NaCl + NaClO + H2O 在C处用湿润的淀粉—KI试纸检验,若试纸变蓝则说明没有吸收完全. NaClO NaCl + H2O ![]() NaClO + H2 ↑ ACBD
NaClO + H2 ↑ ACBD
【解析】试题分析:用石墨作电极电解饱和氯化钠溶液制备消毒液,其原理是将阳极产生的氯气与阴极产生的氢氧化钠反应生成次氯酸钠。通电时,为使Cl2被完全吸收,氯气应在b所连接的电极上生成,则b为电源正极,a为负极。氯气从溶液底部生成后,气泡上升与阴极生成的氢氧化钠反应生成次氯酸钠。
(1)电源中电极a的名称是负极。
(2)氯气被吸收时所发生反应的化学方程式为2NaOH + Cl2 == NaCl + NaClO + H2O。
(3)检验Cl2是否吸收完全,可采用的方法是在C处用湿润的淀粉—KI试纸检验,若试纸变蓝则说明没有吸收完全。
(4)研究表明,当NaCl刚好电解完时,溶液中只有一种溶质,则该溶质最有可能是NaClO。由此可以用一个化学方程表示该容器中所发生的化学反应,该化学方程式为NaCl + H2O ![]() NaClO + H2 ↑ 。
NaClO + H2 ↑ 。
(5)为防止此入杂质,NaCl中的Mg2+通常用NaOH溶液沉淀,SO42-通常用BaCl2溶液沉淀,Ca2+通常用Na2CO3溶液沉淀。为了将杂质完全除去,除杂试剂要稍稍过量,而过量的试剂也要除去,所以Na2CO3溶液一定要在BaCl2溶液之后加,等杂质离子全部沉淀后,过滤,向滤液中加盐酸除去过量的氢氧化钠和碳酸钠。所以使用试剂正确的顺序可以是(ACBD或ABCD或CABD )。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】将氯气通入到水中所发生反应的化学方程式为______________________。已知生成物之一是一种弱酸,试写出该物质在水溶液中的电离方程式______________。某同学将有色布条浸泡在新制的氯水中,发现布条很快被漂白。对此他认为可能是因为氯水中含有某种粒子使布条褪色,于是他提出如下的假设,请你帮他设计实验方案以验证他的假设。
编号 | 假设原因 | 验证方案 |
1 | 可能是因为Cl2分子 | A:_____________ |
2 | 可能是因为H+ | B:_____________ |
3 | 可能是因为Cl- | C:_____________ |
4 | 可能是因为HClO | ———————————————— |
5 | 可能是因为ClO- | D:_____________ |