题目内容
13.下列各组物质中,都是强电解质的是( )| A. | NaOH、蔗糖、NH3•H2O | B. | NH4Cl、HClO、Na2S | ||
| C. | CH3COONa、HCl、BaSO4 | D. | NaCl、SO2、Ba(OH)2 |
分析 电解质是指:在水溶液或熔融状态下都能导电的化合物.能导电是电解质自身能电离出自由移动的离子;单质、混合物既不是电解质也不是非电解质.强电解质是指在水溶液中,或熔融状态下能完全电离的化合物,据此即可解答.
解答 解:A、蔗糖不能电离,属于非电解质,一水和氨溶于水部分电离,属于弱电解质,故A错误;
B、次氯酸为弱酸,部分电离,属于弱电解质,故B错误;
C、CH3COONa、HCl、BaSO4分别属于盐、强酸、盐,均能完全电离,属于强电解质,故C正确;
D、二氧化硫不能电离,属于非电解质,故D错误,
故选C.
点评 本题考查了强电解质的判断,抓住强电解质是在水溶液中或熔融状态下,能完全电离是解答本题的关键,题目难度不大,平时学习注意概念的辨析、基础知识的积累.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
3.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| D. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
4.下列有关化学科学的说法中正确的是( )
| A. | 化学是科学研究的内容,与普通百姓的生活没有关系 | |
| B. | 化学研究只能认识分子,不能制造分子 | |
| C. | 化学家可以制造出自然界中不存在的物质 | |
| D. | 化学研究只会造成严重的环境污染,最终人类将毁灭在化学物质中 |
18.如图所示装置,能够组成原电池且有气泡产生的是( )
| A. | 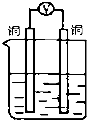 稀硫酸 | B. | 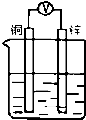 稀硫酸 | C. | 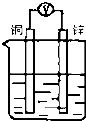 硫酸铜溶液 | D. |  乙醇溶液 |
5.当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A. | 硅酸溶胶 | B. | 氯化钠溶液 | C. | 氯化铁溶液 | D. | 硫酸铜溶液 |
2.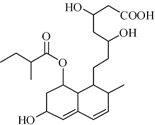 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 1mol该物质与1molBr2发生加成反应,产物有2种 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与1molNaOH反应 |
7.连二亚硫酸钠(Na2S2O4),是印刷工业中重要的还原剂.某小组进行如下实验:
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
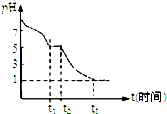
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
(3)资料显示:保险粉、H2O2均可用于纸浆漂白.写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:S2O42-+3H2O2=2SO42-+2H++2H2O_.
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】

(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
 (2)氮原子
(2)氮原子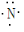 (3)Na2S
(3)Na2S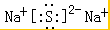 (4)H2O
(4)H2O .
.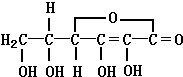 维生素C是一种水溶性维生素,其水溶液呈酸性.它的分子式是C6H8O6,人体缺乏这种维生素,易患坏血症,所以维生素C又称抗坏血酸.维生素C的结构简式如图.在新鲜水果、蔬菜、乳制品 中都富含维生素C,用维生素C的性质解释下列现象:
维生素C是一种水溶性维生素,其水溶液呈酸性.它的分子式是C6H8O6,人体缺乏这种维生素,易患坏血症,所以维生素C又称抗坏血酸.维生素C的结构简式如图.在新鲜水果、蔬菜、乳制品 中都富含维生素C,用维生素C的性质解释下列现象: