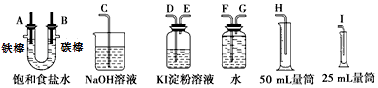
��Ŀ����
����Ŀ��ұ������һ�����������ַ������ٽ�̿������ˮú����H2��CO�������ۻ��ý����û������ܵ�ⷨ�����ַ���������ȱ�㣬�ڹ�ҵ�Ͼ���Ӧ�ã�
��1��һ����ɫ����A����ȵ�̿��Ӧ���õ���һ����ɫ����B��B�����ȵ�����ͭ��Ӧ���ֵõ�A����A��B�ֱ�Ϊ������ţ���
A.O2��CO2
B.O2��CO
C.CO2��CO
D.CO��CO2
��2������˵���������������ţ���
A.�ԷϾɽ�����õĴ��������ǻ��ա�������
B.��������Ҫ������ʯ�ĸ�����ұ������������
C.���ý�����ұ������ͨ�����������Һ�Ƶ�
D.�Ȼ�ԭ���л�ԭ���н�̿��һ����̼����������ý�����
��3���ѣ�Ti���С�δ��������֮�ƣ���ҵ�ϳ���TiCl4+2Mg ![]() Ti+2MgCl2��ú���״�ѣ��÷�Ӧ���������ֻ����н���������ţ���
Ti+2MgCl2��ú���״�ѣ��÷�Ӧ���������ֻ����н���������ţ���
A.ϡ��������
B.������
C.������
D.CO2������
���𰸡�
��1��C
��2��C
��3��A
���������⣺��1���ܺ����ȵ�����ͭ��Ӧ��������һ����̼��������һ����̼������ͭ��Ӧ��������ͭ�Ͷ�����̼������������ͭ��Ӧ����ͭ��ˮ��������̼�ܺ����ȵ�ľ̿��Ӧ����һ����̼��ˮ���ܺ����ȵ�ľ̿��Ӧ����A��һ����̼��B�Ƕ�����̼����ѡ��C����2��A���ԷϾɽ�������ô��������ǻ��ա����ã��������Խ�Լ������Դ�����Ͽɳ�����չ�����A��ȷ��B������������Ҫ������߽���Ԫ�صĺ�����Ȼ��ұ���õ��ֲ�Ʒ���پ�������B��ȷ��C�����ý�����ұ���е�ⷨ�����ȷֽⷨ���û����ȣ���ⷨ�ǵ���������C����D����ԭ���н�̿��һ����̼����������ý����ȳ���������ұ��ʱ�Ļ�ԭ������D��ȷ����ѡ��C����3������þ���ʻ��ã��ܹ��͵�����������������̼��Ӧ������ѡ��ϡ�����壻��ѡ��A��

����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ(Zn��Cu�ܺ���ԼΪ99%)����ͭ���Ʊ�ZnO�IJ���ʵ��������£�
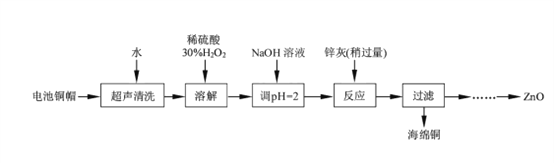
��1����ͭñ�ܽ�ʱ����H2O2��Ŀ����_______________���û�ѧ����ʽ��ʾ����
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽����_________________��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�2Cu2����4I��=2CuI(��ɫ)����I2��I2��2S2O32��=2I����S4O62��
�ٵζ�ѡ�õ�ָʾ��Ϊ________________���ζ��յ�۲쵽������Ϊ________________��
�����ζ�ǰ��Һ��H2O2û�г��������ⶨ��Cu2���ĺ�������______________������ƫ������ƫ����������������
��3����֪pH��11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2�����±��г��˼����������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol/L������
��ʼ������pH | ��ȫ������pH | |
Fe3�� | 1.1 | 3.2 |
Fe2�� | 5.8 | 8.8 |
Zn2�� | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
�ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��������Һ�м���30%��H2O2ʹ���ַ�Ӧ��
�ڵμ�1.0 moL/L���������ƣ�����pHԼΪ_________________��ʹFe3��������ȫ��
�۹��ˣ�
������Һ�еμ�1.0 moL/L���������ƣ�����pHԼΪ________��ʹZn2��������ȫ��
��____________________________��
��900�����ա�
����Ŀ���������ʷ������ȷ�����
�� | �� | �� | ���������� | |
A | ���� | ���� | ���� | �������� |
B | �������� | ���� | ʳ�� | ����ͭ |
C | �������� | ���� | ̼����� | ˮ |
D | �������� | ̼�� | ��ʽ̼��ͭ | ������̼ |
A.AB.BC.CD.D