题目内容
标准状况下,3.36L CO2通入100mL的NaOH溶液中,当CO2全部被吸收后,减压蒸发,最后得14.8g白色固体,求原NaOH的浓度。
答案:
解析:
提示:
解析:
| 若产物全部是 m( 若产物全部是 m( 现12.6<14.8<15.9,故所得固体为Na2CO3和NaHCO3的混合物。 设Na2CO3,NaHCO3分别为xmol,ymol 则有 所以c(NaOH) = 原NaOH物质的量浓度为2.5mol·L-1
|
提示:
| CO2通入NaOH溶液中其产物可能是Na2CO3,NaHCO3或两者兼有之,减压下蒸发可使水的沸点降低,避免产物NaHCO3分解。可通过简单的讨论来解决问题。
|

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
| 下列说法正确的是( ) |
| A、标准状况下,3.36升HF溶于水配成l升溶液,溶液中F-浓度为0.15mol/L | ||||||||||
B、已知
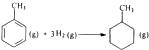 的△H为-384kJ?mol-1 的△H为-384kJ?mol-1 | ||||||||||
| C、常温下,pH=7的CH3COONa溶液中,c(CH3COO-)=c(Na+) | ||||||||||
| D、常温下,1升0.10 mol?L-1NH4C1溶液与2升0.05 mol?L-1NH4Cl溶液使中,所含NH+4的数目相等 |