题目内容
| 下列说法正确的是( ) |
| A、标准状况下,3.36升HF溶于水配成l升溶液,溶液中F-浓度为0.15mol/L | ||||||||||
B、已知
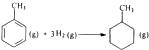 的△H为-384kJ?mol-1 的△H为-384kJ?mol-1 | ||||||||||
| C、常温下,pH=7的CH3COONa溶液中,c(CH3COO-)=c(Na+) | ||||||||||
| D、常温下,1升0.10 mol?L-1NH4C1溶液与2升0.05 mol?L-1NH4Cl溶液使中,所含NH+4的数目相等 |
分析:A.HF是弱电解质,在水溶液里部分电离;
B.苯环中不存在碳碳双键和碳碳单键,是处于单键和双键之间的特殊键;
C.常温下,pH=7的醋酸钠溶液中c(OH-)=c(H+),任何电解质溶液都呈中性,根据电荷守恒判断;
D.常温下,氯化铵溶液中,铵根离子水解程度与溶液浓度成反比.
B.苯环中不存在碳碳双键和碳碳单键,是处于单键和双键之间的特殊键;
C.常温下,pH=7的醋酸钠溶液中c(OH-)=c(H+),任何电解质溶液都呈中性,根据电荷守恒判断;
D.常温下,氯化铵溶液中,铵根离子水解程度与溶液浓度成反比.
解答:解:A.标况下,3.36LHF的物质的量是0.15mol,HF是弱电解质,在水溶液里部分电离,所以该溶液中F-浓度小于0.15mol/L,故A错误;
B.苯环中不存在碳碳双键和碳碳单键,是处于单键和双键之间的特殊键,所以无法计算该反应的焓变,故B错误;
C.常温下,pH=7的醋酸钠溶液中c(OH-)=c(H+),任何电解质溶液都呈中性,根据电荷守恒得c(OH-)+c(CH3COO-)=c(Na+)+c(H+),所以得c(CH3COO-)=c(Na+),故C正确;
D.常温下,氯化铵溶液中,铵根离子水解程度与溶液浓度成反比,所以常温下,1升0.10 mol?L-1NH4C1溶液与2升0.05 mol?L-1NH4Cl溶液使中,所含NH+4的数目前者大,故D错误;
故选C.
B.苯环中不存在碳碳双键和碳碳单键,是处于单键和双键之间的特殊键,所以无法计算该反应的焓变,故B错误;
C.常温下,pH=7的醋酸钠溶液中c(OH-)=c(H+),任何电解质溶液都呈中性,根据电荷守恒得c(OH-)+c(CH3COO-)=c(Na+)+c(H+),所以得c(CH3COO-)=c(Na+),故C正确;
D.常温下,氯化铵溶液中,铵根离子水解程度与溶液浓度成反比,所以常温下,1升0.10 mol?L-1NH4C1溶液与2升0.05 mol?L-1NH4Cl溶液使中,所含NH+4的数目前者大,故D错误;
故选C.
点评:本题考查了离子浓度大小的判断、弱电解质的电离等知识点,明确苯环中存在的碳碳键特点、含有弱根离子的盐与溶液浓度的关系是解本题关键,再结合电荷守恒来分析解答,易错选项是D,注意弱电解质电离程度、盐类水解程度与电解质溶液的关系,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目