题目内容
【题目】常温下,将20.0g质量分数为14.0%的KHCO3溶液跟30.0g质量分数为24.0%的KHCO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数__________。
(2)混合后溶液的物质的量浓度________。
(3)在1000g水中需溶解___________摩尔KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等?
【答案】 20% 2.3 mol·L-1 2.5mol
【解析】(1)20.0g质量分数为14.0%的KHCO3溶液中溶质的质量m1=20.0g×14.0%=2.8g;30.0g质量分数为24.0%的KHCO3溶液溶质的质量m2=30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为![]() ×100%=20%,答:混合后溶液的质量分数为20%;
×100%=20%,答:混合后溶液的质量分数为20%;
(2)混合液中溶质的质量为2.8g+7.2g=10g,溶质的物质的量为n=![]() =0.1mol,溶液的体积为V=
=0.1mol,溶液的体积为V=![]() =
=![]() L,所以溶液的物质的量浓度为c=
L,所以溶液的物质的量浓度为c=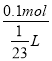 =2.3mol/L,答:混合后溶液的物质的量浓度为2.3mol/L;
=2.3mol/L,答:混合后溶液的物质的量浓度为2.3mol/L;
(3)设需要KHCO3的物质的量为xmol,KHCO3的质量为100x,根据(1)可知,KHCO3的质量分数为20%,则ω=20%=![]() =
=![]() ×100%,解得:x=2.5mol,答:在1 000g水中需溶解2.5mol KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等。
×100%,解得:x=2.5mol,答:在1 000g水中需溶解2.5mol KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等。

练习册系列答案
相关题目


