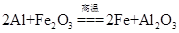题目内容
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速。完成下列填空:
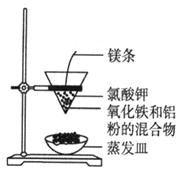
(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是: ;
(2)硅与铝同周期。地壳里硅、铝的含量硅 铝(填>,<或=)。SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。钠长石(NaAlSi3O8)的氧化物形式 ,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由此可推知钙长石的化学式为 ;
(3)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是 和 。
(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是: ;
(2)硅与铝同周期。地壳里硅、铝的含量硅 铝(填>,<或=)。SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。钠长石(NaAlSi3O8)的氧化物形式 ,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由此可推知钙长石的化学式为 ;
(3)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是 和 。
(1).铺上一层KClO3粉末,点燃插入的镁条(2分)
(2).> Na2O·Al2O3·6SiO2 CaAl2Si2O8 (1+1+2=4分) (3) 0.4mol 和 0.6mol (每空2分
(2).> Na2O·Al2O3·6SiO2 CaAl2Si2O8 (1+1+2=4分) (3) 0.4mol 和 0.6mol (每空2分
试题分析:(1)铝热反应是重要的氧化还原反应,其正确的操作方法是先将金属氧化物烘干,再将其与铝粉按一定质量比混合,得到铝热剂,然后在铝热剂上面铺一层铺上一层氧化剂KClO3粉末,目的是来促使反应的继续进行。在氧化剂中插入镁条并引燃该反应就迅速发生。(2)地壳里各种元素含量从多到少的顺序是氧、硅、铝、铁、钙、钠、钾、镁氢等。所以是硅>铝。硅酸盐结构复杂,常用氧化物的形式表示。钠长石(NaAlSi3O8)的氧化物表示是:Na2O·Al2O3·6SiO2。根据氧个数相等及所含元素的种类,结合其化合价,钙长石的化学式为CaAl2Si2O8 。(3)铝合金由Al、Si、Cu、Mg组成,向第一份中加入足量NaOH溶液,Al、Si反应,向另一份中加入足量的稀盐酸,Al、Mg反应。称得滤渣质量相差1.60g,说明Si、Mg相差1.60g。等质量的铝在足量的NaOH溶液和稀盐酸中放出的氢气体积相等。收集得到的两份气体的体积相差2240mL,即0.1mol说明每一份混合物中硅、镁放出氢气的物质的量之差为0.1mol。原混合物含硅、镁的物质的量分别是X、Y。则根据方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑,Mg+2HCl=MgCl2++H2↑.可得│2X-Y│="2×" 0.1,│24Y- 28X│="2×" 1.6。解得X="0." 4,Y=0.6

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目