题目内容
1.当 0.1mol/L的CH3COOH溶液达到电离平衡时,下列关系正确的是( )| A. | c(CH3COO- )=c( H+ ) | B. | c(CH3COOH)<0.1mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(H+)=c(OH-) |
分析 溶液中存在CH3COOH?CH3COO-+H+,电离的程度不大,溶液显酸性,以此来解答.
解答 解:A.溶液中存在醋酸的电离、水的电离,则c(CH3COO- )<c( H+ ),故A错误;
B.0.1mol/L的CH3COOH溶液,存在电离平衡,醋酸发生电离,则c(CH3COOH)<0.1mol/L,故B正确;
C.电离的程度不大,则c(CH3COOH)>c(CH3COO-),故C错误;
D.溶液显酸性,则c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查弱电解质的电离平衡,为高频考点,把握弱电解质的电离平衡、电离程度为解答的关键,侧重分析与应用能力的考查,注意溶液中存在水的电离平衡,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
11.下列叙述正确的是( )
| A. | 分子晶体中都存在共价键 | |
| B. | F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关 | |
| C. | 氯元素含氧酸酸性 HClO>HClO2 | |
| D. | 只要是离子化合物,其熔点一定比共价化合物的熔点高 |
12.下列实验中操作及现象与结论对应关系不正确的一组是( )
| 实验操作 | 实验现象 | 实验结论 | |
| A | 碳酸钠粉末中加入适量醋酸 | 产生无色无味的气体 | 醋酸的酸性比碳酸强 |
| B | 乙烯通入酸性高锰酸钾溶液中 | 溶液褪色 | 乙烯能被高锰酸钾氧化 |
| C | 点燃苯 | 火焰明亮,并带有浓烟 | 苯的含碳量高 |
| D | 石蕊溶液中滴入乙酸 | 石蕊溶液变红色 | 乙酸是强酸 |
| A. | A | B. | B | C. | C | D. | D |
9.反应A2+3B2?2AB3以下表示的反应速率中,速率最大的是( )
| A. | υ(A2)=0.4 mol•L-1•min-1 | B. | υ(B2)=1.2 mol•L-1•min-1 | ||
| C. | υ(AB3)=0.6 mol•L-1•min-1 | D. | υ(AB3)=0.9 mol•L-1•min-1 |
16.在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L.向其中加入1.92克铜粉微热,待充分反应后,溶液中的Cu2+物质的量浓度为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
6.25℃时,下列各组离子在指定溶液中可能大量共存的是( )
| A. | pH=l的溶液中:Na+、K+、MnO4-、I- | |
| B. | 无色溶液中:Al3+、NH4+、Cl-、S2- | |
| C. | 由水电离出的c(H+)=1×10 -3 mol•L-1的溶液中:Mg 2+、Cu 2+、SO42-、NO3- | |
| D. | 0.lmol•L-1FeC13溶液中:Fe 2+、NH 4 +、SCN-、SO42- |
13.下列实验装置图能达到实验目的是( )
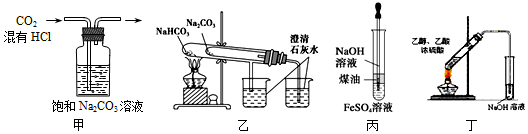

| A. | 图甲可除去CO2种混有的HCl气体 | |
| B. | 图乙可用于比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 图丙可制得Fe(OH)2沉淀且一定时间内不变质 | |
| D. | 图丁可制得并分离出乙酸乙酯 |
10.某有机物的结构简式如图所示  ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )
 ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )| A. | 该有机物的化学式为C10H14 | |
| B. | 它的一氯代物有6种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生取代、加成、氧化和还原反应 |
15.分子式为C5H12O,分子中含有3个甲基,且能与金属钠反应的有机物共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |