题目内容
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣565.2kJmolˉ1 , 下列说法不正确的是( )
A.CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.6 kJ?molˉ1
O2(g)═CO2(g)△H=﹣282.6 kJ?molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
【答案】B
【解析】解:A、反应热的大小与物质的量成正比例,所以1mol一氧化碳燃烧放出的热量为:282.6 kJ,则反应热的化学方程式为CO(g)+ ![]() O2(g)═CO2(g)△H=﹣282.6 kJmolˉ1 , 故A正确B、气体变成固体要放出热量,所以2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量大于565.2 kJ,故B错误;
O2(g)═CO2(g)△H=﹣282.6 kJmolˉ1 , 故A正确B、气体变成固体要放出热量,所以2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量大于565.2 kJ,故B错误;
C、正反应是放热反应所以反应物的总能量高于生成物的总能量,所以2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量,故C正确;
D、根据化学反应的实质,因为反应物总能量大于生成物总能量,该反应为放热反应,则拆开反应物所有键所吸收的总能量小于形成生成物所放出的总能量,故D正确;
故选B.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

 华东师大版一课一练系列答案
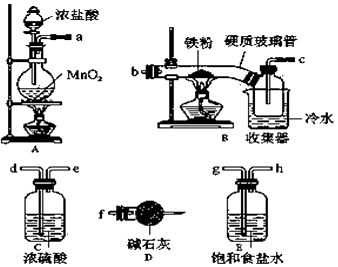
华东师大版一课一练系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
请回答下列问题: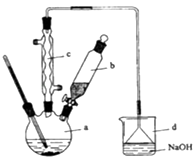
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.