题目内容
【题目】硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为:SO2(g)+ 1/2O2(g) ![]() SO3(g)。
SO3(g)。
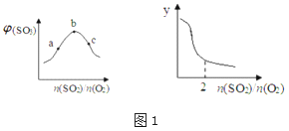
(1)恒温恒压下,平衡体系中SO3的体积分数和y与SO2、O2的物质的量之比的关系如图1:则b点n(SO2)/n(O2)=________________;y为_____________(填编号)。
A.平衡常数
B.SO3的平衡产率
C.O2的平衡转化率
D.SO2的平衡转化率
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400~650℃时,Kp与温度(T /K)的关系为lgKp= - 4.6455,则在此条件下SO2转化为SO3反应的ΔH_______(填“>0”或“<0”)。
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5![]() SO3+V2O4 K1 1/2O2+V2O4
SO3+V2O4 K1 1/2O2+V2O4![]() V2O5 K2
V2O5 K2
则在相同温度下2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因是_____________________________。
(4)在7.0% SO2、11% O2、82% N2(数值均为气体体积分数)时,SO2平衡转化率与温度、压强的关系如图2,则列式计算460℃、1.0 atm下,SO2(g)+1/2 O2(g) ![]() SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。
SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。

(5)综合第(4)题图给信息,工业生产压强通常采用常压的原因是__________________________。
【答案】 2 D <0 (K1×K2)2 降低反应的活化能,活化分子百分数增大,有效碰撞几率提高 Kp=113/atm1/2 常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高
【解析】(1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大,b点三氧化硫体积分数最大,此点处n(SO2)/n(O2)=2:1;由图象可知,n(SO2)/n(O2)越大,y值越小,A.平衡常数仅与温度有关,所以n(SO2)/n(O2)变化,平衡常数不变,不符合图像,故错误;B.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO3的平衡产率越大,不符合图像,故错误;C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则O2的转化率越大,不符合图像,故错误;D.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO2的平衡转化率越小,符合图像,故正确;故选D;故答案为:2;D;
(2)根据图知,升高温度平衡常数减小,说明平衡逆向移动,正反应是放热反应,焓变小于0,故答案为:<0;
(3)将方程式2(①+②)得2SO2(g)+O2(g)![]() 2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
(4)混合气体中7.0%SO2、11%O2、82%N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,剩余的n(SO2)=7mol×3%=0.21mol,剩余的n(O2)=11mol-![]() ×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol +82mol =96.605mol,反应前后物质的量之比等于其压强之比,则反应后压强=
×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol +82mol =96.605mol,反应前后物质的量之比等于其压强之比,则反应后压强=![]() ×1atm=0.9579atm,二氧化硫的分压=
×1atm=0.9579atm,二氧化硫的分压=![]() ×0.9579atm,氧气分压=
×0.9579atm,氧气分压=![]() ×0.9579atm,三氧化硫分压=
×0.9579atm,三氧化硫分压=![]() ×0.9579atm,化学平衡常数Kp=
×0.9579atm,化学平衡常数Kp= =
=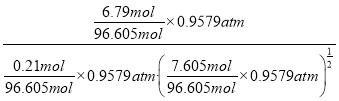 =113/atm1/2,故答案为:113/atm1/2;
=113/atm1/2,故答案为:113/atm1/2;
(5)根据图知,在400~500℃时二氧化硫转化率较大,反应速率快,此时催化剂的活性最高,所以工业生产最适宜的温度范围为400~500℃,又常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,故答案为:常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高。