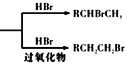
题目内容
【题目】镁、铝在生产生活中有广泛的应用.回答下列问题:
(1)铝的原子结构示意图为 . 它位于元素周期表的第周期,第族.
(2)实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为 .
(3)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为 .
(4)检验某溶液中是否含有Fe3+的操作方法是 .
【答案】
(1)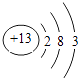 ;三;ⅢA
;三;ⅢA
(2)Al3++3NH3?H2O═Al(OH)3↓+3NH4+
(3)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(4)向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子
【解析】解:(1)原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;原子结构示意图为 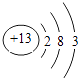 .
.
所以答案是: 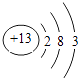 ;三;ⅢA;(2)一水合氨不会溶解氢氧化铝,氯化铝与氨水反应的离子方程式为:Al3++3NH3H2O═Al(OH)3↓+3NH4+,
;三;ⅢA;(2)一水合氨不会溶解氢氧化铝,氯化铝与氨水反应的离子方程式为:Al3++3NH3H2O═Al(OH)3↓+3NH4+,
所以答案是:Al3++3NH3H2O═Al(OH)3↓+3NH4+;(3)高温下铁会跟水蒸气发生反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2,
Fe3O4+4H2,
所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(4)铁离子能够与硫氰根离子反应生成红色的络合物硫氰化铁,据此检验铁离子是否存在,所以检验铁离子是否存在的最简便的方法为:向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子,
Fe3O4+4H2;(4)铁离子能够与硫氰根离子反应生成红色的络合物硫氰化铁,据此检验铁离子是否存在,所以检验铁离子是否存在的最简便的方法为:向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子,
所以答案是:向待测液中加入KSCN溶液,如果溶液变为红色,即可证明溶液中含有铁离子.
【考点精析】解答此题的关键在于理解铝的化学性质的相关知识,掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.

【题目】针对下面四套实验装置图,下列说法正确的是

A. 图1装置牺牲镁保护铁
B. 用图2装置铁钉发生吸氧腐蚀腐蚀导致试管中水面上升
C. 图3装置中Mg作负极,Al作正极
D. 用图4装置对二次电池进行充电
【题目】如图图象中,纵坐标为沉淀物的物质的悬,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是 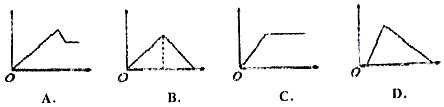
溶液 | 加入物质 | 对应的图象 |
⑴饱和石灰水 | 通过量CO2气体 | |
⑵氯化铝溶液 | 加入过量氨水 | |
⑶MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | |
⑷含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |